Цели урока:
- Продолжить систематизацию и обобщение знаний по теме “Металлы”; на уроке изучаются физические свойства алюминия, железа, меди, цинка, золота и некоторые химические свойства цинка, алюминия и меди.
- Совершенствовать умение учащихся самостоятельно получать знания, определять проблемную ситуацию и находить пути её решения;
- Совершенствовать умение учащихся отражать изученный материал в виде схем, таблиц с использованием информационных технологий.
Задачи урока:
- Знакомство учащихся с металлами разных групп, их свойствами и применением.
- Рассмотреть на уроке этимологию, физические свойства алюминия, железа, меди, цинка, золота и составить таблицу; а также познакомить учащихся с некоторыми химическими свойствами цинка, алюминия и меди.
- Изучить амфотерные свойства соединений цинка и алюминия.
- Оформить полученные на уроке знания в виде буклета.
Форма организации занятий: групповая работа учащихся, индивидуальная, фронтальная.
План урока
Учащиеся разделены на группы по 4 – 5 человек. Заранее они подготовили карточки с цифрами от 1 до 4 и компьютерные презентации по разным металлам. (Это задание подразумевало групповую работу дома).
Оборудование: компьютеры, мультимедиа, мультимедийное учебное пособие по химии для 9 класса, энциклопедии, научные словари и справочники, изделия из разных металлов, применяемых в быту, цинк, раствор соляной кислоты, аппарат Киппа, коллекции: “Металлургия”, “Алюминий и его соединения”, “Минералов”, электрические лампы.
1. Вступление учителя.
На экране вы видите старинное изображение. Что показано на рисунке?
(Алхимические символы металлов: серебра (Луны), золота (Солнце), железа, олова, свинца, меди. В центре – символ ртути).
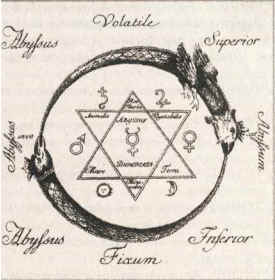
Если учащиеся затрудняются, можно предложить другие рисунки. Учитель задает вопрос: “Что объединяет все эти рисунки?”




Учащиеся определяют, что общее на всех рисунках – металлы.
Учитель: Сегодня мы продолжаем знакомство с металлами. Строение металлов и расположение их в периодической таблице химических элементов мы разбирали на прошлом уроке, теперь по тестовым заданиям повторим пройденный материал. (Учащимся предлагается индивидуальная работа по тестам по карточкам с цифрами. Вопросы и варианты ответов появляются на экране). Учащиеся, прочитав вопрос и предложенные варианты ответов, выбирают правильный и поднимают карточку с нужной цифрой.
Задание № 1. Прочитайте вопрос и предложенные варианты ответов, выберите правильный и поднимите соответствующую карточку с цифрой. Объясните свой выбор.
1. В какой группе элементов приведены символы только металлов:
а) Na, In, Sr;
б) Са, Н, Zn;
в) Аи, Mg, Si;
г) Se, Hg, Си?
2. Элементы-металлы преобладают в:
а) 1-м периоде;
б) 2-м периоде;
в) 3-м периоде;
г) 4-м периоде.
3. Лишний с точки зрения группового названия металл:
а) натрий;
б) серебро;
в) рубидий;
г) калий.
4. Какое прилагательное часто применяют к дождю:
а) железный;
б) оловянный;
в) медный;
г) серебряный?
С чем, на ваш взгляд, это связано?
5. Почему наши предки проверяли подлинность золотой монеты на зуб:
а) золото имеет солоноватый вкус;
б) золото при покусывании издает характерный
скрежет;
в) из-за мягкости металла на золотой монете
оставались следы зубов;
г) на зубах при этом образовывался золотистый
налет?
6. Какое прилагательное пишется с одной буквой л:
а) бери...иевый;
б) а...юминиевый;
в) па...адиевый;
г) мета...ический?
7. Название какого металла не имеет отношения к космосу:
а) ниобий;
б) палладий;
в) церий;
г) плутоний?
8. Большая часть элементов Периодической системы является:
а) металлами;
б) неметаллами;
в) благородными газами;
г) элементами, сочетающими свойства металлов и
неметаллов.
9. Полностью из элементов-металлов состоит главная подгруппа:
а) I группы;
б) II группы;
в) IV группы;
г) V группы.
10. Лишний с точки зрения группового названия элемент:
а) барий;
б) стронций;
в) кальций;
г) бериллий.
11. С точки зрения строения атома металлы характеризуются:
а) большим радиусом атома, большим числом
электронов на внешнем уровне;
б) малым радиусом атома, большим числом
электронов на внешнем уровне;
в) большим радиусом атома, небольшим числом
электронов на внешнем уровне;
г) малым радиусом атома, небольшим числом
электронов на внешнем уровне
12. Элемент, который занимает промежуточное положение между металлами и неметаллами:
а) барий;
б) сера;
в) германий;
г) ртуть.
13. Восстановительные свойства металлов при прочих равных условиях усиливаются:
а) увеличением числа электронов на внешнем
энергетическом уровне;
б) с уменьшением радиуса атома;
в) с увеличением радиуса атома;
г) верного ответа среди перечисленных нет.
(После краткого обсуждения ответов карточки с цифрами нужно убрать).
Учитель. Для чего нужно знать строение атомов.
Учащиеся. От строения зависят свойства веществ.
Учитель. На ваших столах лежат карточки определенного цвета, на которой указан металл, свойства которого ваша группа будет сегодня рассматривать. Каждая группа заносит необходимые данные в групповой буклет. Эти работы будут вывешены в кабинете химии для ознакомления другими учащимися. На следующем уроке каждая группа представляет свой буклет.
Задание № 2.
Учитель. Вы видите карточку с названием металла. Найдите по словарям, энциклопедиям этимологию данного металла, высказывания о нем, занесите в файл компьютера.
Задание № 3.
Учитель. Используя таблицу химических элементов, составьте схему строения атома вашего металла. Определите число нуклонов и электронов, распределите электроны по энергетическим уровням, составьте электронные конфигурации.
Задание № 4.
Учитель. Перед вами на столах разложены разные предметы, с которыми мы встречаемся часто в быту. Рассмотрите эти предметы, назовите их и вспомните, из какого металла они изготовлены. Изучите физические свойства предложенного металла. Используя свои наблюдения и данные справочников по физике и химии, заполните таблицу. (Работа в группах с металлическими предметами и справочной литературой).
Каждая группа составляет и заполняет таблицу “Физические свойства металла” в своих тетрадях, а один участник от группы – на компьютере.
В групповом буклете разные участники от группы записывают.
- Название металла.
- Этимология названия.
- Строение атома.
- Таблица “Физические свойства металла”.
| Название металла, его обозначение | Металл. блеск | Плотность | Твердость | Цвет | Температура плавления | Удельная теплоемкость | Электро и тепло проводность |
По желанию учащихся в таблицу могут быть добавлены еще графы.
Задание № 5.
Учитель.
Вы изучили физические свойства своего металла, заполнили таблицы, а теперь объясните, почему на ваших столах лежит карточка определенного цвета. Какое отношение имеет ваш металл к этому цвету?
Возможные варианты ответов учащихся. Серый цвет - цинк – металл серого цвета, как и многие другие металлы, например, алюминий, хром.
Красный цвет – железо – железо получают при
высокой температуре, около 1500 градусов, цвет
“красного коления” или ржавчина, соединение
железа – красного цвета.
Желтый – золото – изделия из золота обычно
желтого цвета, так как этот металл имеет желтый
цвет.
Зеленый – медь – медь окрашивает пламя свечи в
зеленый цвет. Изделия из меди окисляются
кислородом воздуха, поэтому при длительном
хранении зеленеют.
Белый – многие соединения алюминия белого цвета.
Задание № 6.
Учитель.
Перед вами обыкновенная лампа, лампа Эдисона или лампа Ладыгина, названная в честь ученых, которые долгие годы работали над ее созданием. Перечислите металлы, которые необходимы для ее изготовления. (Учащиеся работают с учебником, выясняют, из каких металлов изготовлена лампа). Затем на экране появляется изображение лампы, учащиеся перечисляют металлы, которые используются для ее производства.
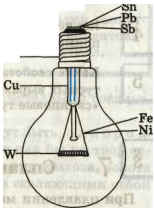
Учитель.
Мы познакомились с физическими свойствами некоторых металлов, теперь познакомимся, в каком виде встречаются металлы в природе. Первая презентация “Распространение металлов в природе”. (Учащиеся 1 группы представляют свое домашнее задание).
Учащиеся после просмотра составляют схему.
Схема № 1. “Распространение металлов в природе”.
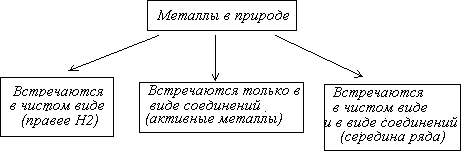
Вывод учащиеся делают, используя ряд напряжения металлов.
Учитель. Познакомимся теперь с применением некоторых металлов. Учащиеся остальных групп показывают свои презентации – домашние задания, посвященные использованию металлов. Каждая группа готовила одно направление, по выбору.
Задание № 7.
Составить уголковую схему “Применение металлов”.
После просмотра презентаций ученики составляют схему.
Схема № 2. Применение металлов.
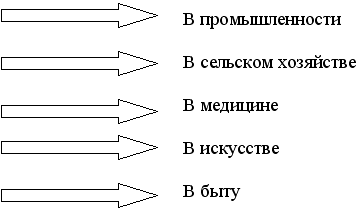
Учитель. Металлы широко используют люди в своей жизни, но без каких знаний невозможно было бы так разнообразно применять металлы и их соединения? Учащиеся отвечают, что без знаний химических свойств.
Учитель. Рассмотрим химические свойства цинка, алюминия и меди.
Демонстрационные эксперименты показывает учитель.
Опыт 1. Взаимодействие металлов с кислотами. Демонстрация аппарата Киппа, в котором цинк взаимодействует с соляной кислотой. Учащиеся записывают уравнения реакции.
Zn + 2H CL = Zn Cl 2 + H 2
Затем учитель показывает опыт, в котором медь опускают в раствор соляной кислоты. Никаких признаков реакции не наблюдается.
Далее алюминий помещают в раствор соляной кислоты и опять наблюдают выделение газа – водорода. Учащиеся записывают уравнения реакции.
2AL + 6H Cl = 2 Al Cl 3 + 3 H2 .
Учащиеся делают вывод, как связаны химические свойства с положением металла в ряду напряжения.
Учитель. Теперь рассмотрим химические взаимодействия металлов и неметаллов. Демонстрируется фильм с опытами: взаимодействие алюминия с бромом и взаимодействие сурьмы с хлором. Учащиеся записывают уравнения реакции.
2Al + 3Br 2 = 2Al Br 3
2Sb + 3 Cl2 = 2 SbCl 3
Учитель. Соединения цинка и алюминия обладают амфотерными свойствами. Для того, чтобы узнать про амфотерные свойства, проведем эксперимент.
Демонстрационный эксперимент. Получение и доказательство амфотерных свойств соединений цинка и алюминия. Учитель получает гидроксид цинка и показывает его взаимодействие с соляной кислотой и гидроксидом натрия. Учащиеся делают вывод, что растворение осадка – признак реакции – наблюдался в обоих случаях. Значит, гидроксид цинка – взаимодействует и с кислотой и с основанием. На экране демонстрируется аналогичный эксперимент с гидроксидом алюминия. Учащиеся делают вывод, что и гидроксид алюминия – амфотерное соединение.
С помощью компьютера учащиеся рисуют круги Эйлера.
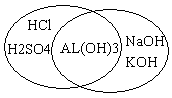
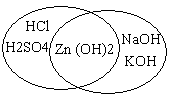
Записывают уравнения реакций.
Al (OH)3 + 3 HCL = ALCl 3 +2 H2O
Al (OH)3 + NaOH = Na Al O2 + 2H2O
Учитель. Реакции взаимодействия гидроксида цинка с соляной кислотой и с гидроксидом натрия, надо будет записать дома.
Задание 8.
Учитель. По изученному материалу, каждая группа в течение урока составляла буклет – презентацию по определенному металлу. В течение нескольких минут обсудите порядок выступления группы и подготовьте свои материалы для сообщений.
Учащиеся делают сообщения и представляют буклеты, составленные по плану:
- Эпиграф про данный металл.
- Этимология металла.
- Строение атома.
- Физические свойства (таблица).
- Распространение в природе.
- Химические свойства (Используя ряд напряжения металлов).
- Применение.
На выступление каждой группы не более 3 минут. Если на данном уроке не хватает времени на представления групп, то лучше перенести обсуждения на следующий урок, заранее вывесить в кабинете составленные группами буклеты по предложенному металлу для просмотра и подготовки к обсуждению.
Учитель. Мы сегодня на уроке изучали свойства металлов, каждый из вас работал индивидуально и в группах, попрошу оценить вас свою работу и заполнить таблицу оценок. У каждой группы таблица.
| Ф.И. | Работа с литературой | Подготовка дом. презентации | Ответы на вопросы тестов | Обсуждение вопросов | Общий бал | |||||
| Самооценка | Оценка группы | Самооценка | Оценка группы | Самооценка | Оценка группы | Самооценка | Оценка группы | Самооценка | Оценка группы | |
| 1. | ||||||||||
| 2. | ||||||||||
| 3. | ||||||||||
Учитель выставляет отметки, учитывая мнение группы и самооценку учащихся.
Домашнее задание. Учащиеся составляют электронный баланс для окислительно–восстановительных реакций, записанных на уроке. Составляют характеристику всех реакций по всем типам. Реакции взаимодействия гидроксида цинка с соляной кислотой и с гидроксидом натрия. По желанию учащиеся могут подготовить компьютерные презентации про ученых Эдисона и Н. Ладыгина.