Цели и задачи:
Образовательные:
- Сформировать знания учащихся о солях как классе неорганических соединений;
-
Привести в систему знания учащихся о классификации солей;
-
Познакомить со свойствами и применением солей.
Развивающие:
-
Развить умения и навыки работы с лабораторным оборудованием и химическими реактивами;
-
Правильно оформлять результаты опытов, составлять уравнения реакций;
-
Развивать умения наблюдать и делать выводы.
Воспитательные:
-
Формирование всесторонне развитой личности;
-
Воспитывать любовь к родному краю;
-
Воспитание трудолюбия, взаимовыручки, умение работать в парах.
Методы: рассказ, беседа, демонстрация презентации “Соли”, выполнение лабораторной работы в парах с реактивами, работа с цифровыми лабораториями.
Оборудование:
Цифровые лаборатории «Архимед», компьютер, мультимедийная презентация по теме урока, раздаточный материал – карточки; образцы солей и минеральной воды; транспаранты для магнитной доски; этикетки от минеральной воды; пробирки, колбы, растворы NaCI, AgNO3, Na2CO3, CuSO4, Fe (гвозди), NaOH, H2SO4, BaCl2, Cu, FeSO4.Тип урока: комбинированный.
Ход урока
1 этап.
Оргмомент. Проверка домашнего задания:- у доски работают учащиеся с домашними упражнениями
- упражнение №1 с.221
- Химические свойства оксида калия
- Химические свойства оксида серы (VI).
- с места: повторить номенклатуру кислотных остатков. Повторить правила: – закончить фразу…
реакция нейтрализации – это …
кислоты – это …
оксиды – это …
классификация оксидов …
2 этап.
Работа по теме урокаНа демонстрационном столе образцы:
- мел (карбонат кальция)
- сода техническая (карбонат натрия)
- медный купорос (сульфат меди)
- поваренная соль (хлорид натрия
О чем мы будем говорить сегодня на уроке? (О солях)
Заполните, пожалуйста, 2 первые колонки в карточках
|
Что знаю по теме урока? |
Что хотел бы узнать? |
Что узнал на уроке? |
|
|
|
|
Соли – самый многочисленный класс веществ.
Задание:
составить формулу, описать свойства солей.- СаСО3 – твердое вещество, белого цвета, нерастворимо в воде.
- Na2CO3 – твердое вещество, белого цвета, хорошо растворимо.
- CuSO4 – твердое вещество, синего цвета, хорошо растворимо.
- NaCl – твердое вещество, белого цвета, хорошо растворимо.
Вывод:
соли - твердые вещества, отличаются цветом, растворимостью в воде.2 Классификация солей – учащиеся в парах работают с карточками
|
Na 2 CO3 |
Al OH Cl2 |
|
Cu SO4 |
Na H CO3 |
|
Cu OH Cl |
Na HSO4 |
Выбрать знакомое, понятное и сгруппировать новые формулы. В итоге получается три группы формул.
а) соли средние (нормальные): Na2CO3, CuSO4 на доске (магнитной) начинаем формировать схему. Записываем уравнение образования средней соли:
2NaOH + H2SO4 = Na2SO4 + 2H2O реакция обмена, нейтрализации.
Na2SO4 2Na+ + SO42- (1 cтупень)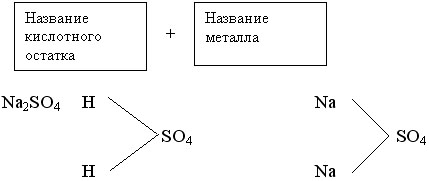
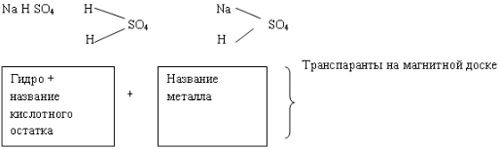
б) соли кислые: NaHСO3, NaHSO4 - результат неполного замещения атомов водорода в кислоте на атом металла.
NaOH + H2SO4 = NaHSO4 + H2O
NaHSO4  Na+
+ HSO4- (1 степень)
Na+
+ HSO4- (1 степень)
HSO4  H+
+ SO42- (2 степень) – эта степень с
меньшей степенью диссоциации.
H+
+ SO42- (2 степень) – эта степень с
меньшей степенью диссоциации.
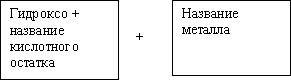
в) соли основные:
Ca(OH)2 + HCl = CaOHCI + H2O
CaOHCl  CaOH+
+ Cl- (1 ступень)
CaOH+
+ Cl- (1 ступень)
CaOH+  Ca2+
+ OH- (2 ступень) очень незначительна.
Ca2+
+ OH- (2 ступень) очень незначительна.
3этап. Закрепление:
провести исследование состава минеральных вод Калининградской области, используя этикетки производителей. Работа выполняется на местах, парами – учащиеся получают карточку с заданиями и этикетку от конкретной воды.В это же время ученики работают у доски с магнитами и карточками по этикеткам от минеральных вод
Задание 1.
Используя этикетку от минеральной воды, исследуйте ее солевой состав:- сделайте заголовок – название воды;
- найдите химический состав, в тетради запишите отдельно катионы (ионы +) и анионы (ионы - )
- составьте из ионов формулы солей (+)
например: 2Na+ + SO42-
 Na2SO4
Na2SO4 - подчеркните формулы кислых солей, назовите их.
- подсчитайте общее число получившихся формул солей
Обсудить полученные результаты.
- Где расположен источник?
- С какой глубины происходит подъем воды?
- К какому типу минеральных вод она относится?
- Какая еще информация есть на этикетке?
- Личное отношение к минеральным водам.
Выслушиваем несколько ответов.
3 группы работают в это время с «Архимедом», определяя рН и вывести результаты исследования на экран в презентацию.
Выслушиваем отчет групп и рекомендации по потреблению минеральной воды.
4 этап Химические свойства солей (практическая работа по группам)
Проведение реакций по группам с реактивами, стоящими на столах.2 свойства солей мы с вами уже изучили.
- Какие? С чем реагируют кислоты? (Ответы ребят и проведение опытов с кислотами и основаниями).
- Что получилось? Комментарии.
- А как вы думаете, с чем еще могут реагировать соли? (Друг с другом)
- Любые соли или есть условие протекания реакции? (Осадок)
- Проведите реакцию между нитратом серебра и хлоридом натрия.
- А как вы думаете, с чем еще могут реагировать соли? ( С металлами)
- Со всеми? (только, стоящими в ряду напряжений до водорода) проделываем опыт с гвоздем.
5 этап Подведение итогов
- Что нового узнали на уроке?
- Что было интересно?
- Выставление оценок
Домашнее задание:
§41, упражнение № 1,5 стр. 225Задача (если останется время, то на уроке; если нет, то домой)
Мы каждый день употребляем в пищу соль - хлорид натрия.
- Где она еще применяется?
Она применяется для обработки кожевенного и мехового сырья.
Ученые подсчитали, что человек в день употребляет 12-15г соли. Сколько соли съели вы за свою жизнь!
Сделаем следующий расчет потребления соли, взяв за основу15г - в сутки.
За месяц 15г х 30 = 450г
За год 450г х 12 = 5400г
Теперь рассчитайте, сколько вы съели соли за свою жизнь. Для этого количество соли, которое вы употребили за год, умножьте на свой возраст.
- Сколько получилось?
Раздаточный материал к уроку
|
Na 2 CO3 |
Al OH Cl2 |
|
Cu SO4 |
Na H CO3 |
|
Cu OH Cl |
Na HSO4 |
Задание 1.
Используя этикетку от минеральной воды исследуйте ее солевой состав:- сделайте заголовок – название воды;
- найдите химический состав, в тетради запишите отдельно катионы (ионы +) и анионы (ионы - );
- составьте из ионов формулы солей (+),
например: 2Na+ + SO42-
 Na2SO4 ;
Na2SO4 ; - подчеркните формулы кислых солей, назовите их;
- подсчитайте общее число получившихся формул солей;
Обсудить полученные результаты.
Методическое руководство по выполнению практической работы «Химические свойства солей»