Цель мероприятия: углубление и обобщение знаний учащихся о классах неорганических соединений. Анализ уровня усвоений знаний по данной теме.
Задачи:
- образовательные: показать связь теоретических знаний и их практического использования
- воспитательные: повысить интерес к предмету, добиться более глубоких и прочных знаний по химии, в частности по теме " Классы неорганических соединений ", своевременно и быстро откликаться на актуальные вопросы и события, воспитывать чувство взаимопомощи, коллективизма, организаторские способности, дисциплину;
- развивающие: развивать речь, память, мышление, воображение, смекалку, самостоятельность.
Форма проведения: игра
Оборудование: игровое поле для каждой команды. Можно использовать либо расчерченные листы ватмана, либо заготовку на интерактивной доске.
Ход мероприятия.
Организационный момент
- Здравствуйте, ребята! Садитесь. Сегодня мы проводим мероприятие в форме занимательной игры. Все мы в детстве играли в морской бой. Сегодня мы тоже будем сражаться, только расстреливать будем космический корабль противника, а вопросы будут посвящены теме: “Классы неорганических соединений”. И так мы начинаем!
Подготовительный этап.
Класс делится на две группы. На доске вывешиваются 2 ватмана с игровым полем, также игровое поле можно расположить на интерактивной доске. Каждая команда строит свой корабль, который располагается произвольно на 7 клетках. Ниже приведены примеры построения корабля.
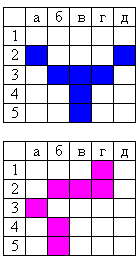
Право первого выстрела определяется с помощью жеребьевки. Для этого на доску вывешиваются 3 разноцветных шарика, или шарики так же могут быть изображены на интерактивной доске. Команда, ответившая первой на вопрос, получает право первого выстрела.
Вопрос: Необходимо определить какой шарик поднимется выше всех, если первый накачен метаном, второй - кислородом, третий – аммиаком.
Правильный ответ: Mr (СН4)=16; Mr (NН3)=17; Mr (O2)=32;
Выше всех поднимется шар, накаченный метаном.
Ход игры.
Команды производят первый выстрел согласно очередности и получают задания. Каждый следующий выстрел может быть произведен только в случае правильного ответа на поставленный вопрос. Если в ходе игры прозвучал не правильный ответ, то команда переделывает неверно выполненное задание. Право выстрела в этом случае команда не получает до тех пор, пока правильно не ответит на вопрос. Каждый член команды записывает решение на своем листе, т.к. в конце урока каждый ученик должен сдать отчет. В течение урока решение задания не рассматривается, озвучивается только ответ, но оценка ученику будет выставлена с учетом, представленного им решения. Место выстрела на игровом поле может помечаться цветом, или отличительным знаком, так же как и “пройденные” клетки, чтобы в ходе игры не возникало путаницы.
Задание к игровому полю.
А 1 - дайте определение оксидов.
Д 1 - дайте определение оснований.
А 5 - дайте определение кислот.
Д 5 - дайте определение солей.
Б 1 – дайте классификацию оксидов.
Д 2 - дайте классификацию оснований.
Г 5 - дайте классификацию кислот.
А 4 - дайте классификацию солей.
В 1 – Оксид SiO2 –
это …………. (кислотный) оксид, потому что
……………
Д 3 – Fe(OH)3
- это …………….(нерастворимое) основание,
потому что ……………
В 5 – H2 SO4
-это …………………..(кислородсодержащая)
кислота, потому что……..
А 3 – FeSO4 –
это ……………………(средняя) соль, потому что…………………….
Г 1 – CuO – это
……………………….. (основной) оксид, потому что
……………
Д 4 – NaOH – это
…………………………(щелочь), потому что……………………
Б 5 – CL-
- это кислотный остаток …………………… (соляной)
кислоты.
А 2 – Fe(HSO4)2
– это …………..(кислая) соль, потому что…………………
Б 2 – CuSO4 называется
………………………………….
Г 2 – HNO3
называется ……………………………
Г 4 – KOH называется
…………………………………
Б 4 – K2O
называется……………………………………………
В 2 – закончите возможную реакцию: SiO2
+ H2O
=……… ; SO3+
H2O
=……… ;
Г 2 - закончите возможную реакцию: CuO+HCL=…………;
CuO+ KOH=
………….;
В 4 - закончите возможную реакцию: CuSO4+HCL=…………;
CuCO3+HCL=…………;
Б 3 - закончите возможную реакцию: SO3+
KOH =……… ; SO3+
Fe(OH)3
=……… ;
В 3 – Задача. При взаимодействии 40 г. гидроксида натрия с раствором серной кислоты, была получена кислая соль. Дайте название, полученной соли и рассчитайте ее массу.
(Правильный ответ: получен гидросульфат натрия массой 120 г.)
Подведение итогов.
“Цена” каждого вопроса в баллах представлена в таблице.
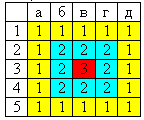
Баллы подсчитываются для всей команды по следующей шкале:
Оценка “5” выставляется, если команда набрала от 9 баллов и выше.
Оценка “4” выставляется, если команда набрала от 7 до 8 баллов.
Оценка “3” выставляется, если команда набрала от 5 до 6 баллов.
Однако оценка ученику может быть ниже или выше командной оценки, т.к. учитывается его работа, которую он заполнял в течение урока и сдал как отчет в конце.
Результаты игры сообщаются учащимся на следующем уроке и выставляются оценки в журнал.
Мероприятия такого плана всегда вызывают бурный восторг у учащихся и желание активно участвовать в игре.