Цели урока: Рассмотреть гомологические ряды, виды изомерии и номенклатуру альдегидов и кетонов. Разобрать строение карбоксильной группы и на этой основе подчеркнуть особенное для альдегидов в сравнении с кетонами. Познакомить учащихся с физическими свойствами представителей этих классов соединений и их значением в живой природе и повседневной жизни человека. На основании строения альдегидов и кетонов спрогнозировать их химические свойства, которые затем рассмотреть в сравнении для обоих классов этих соединений.
Оборудование и реактивы: демонстрационные образцы: глюкоза, ванилин, формалин, ацетон, чистящее или моющее средство (порошок или жидкость) с лимонным запахом; плакат с формулами ванилина, цитраля, феромонов, ацетон, растворы аммиака, нитрата серебра, сульфата меди (II), гидроксида натрия, спиртовка, пробирки. Мультимедиа проектор, компьбтер или ноутбук, экран. На уроке используется презентация. Приложение 1
Ход урока
I. Организационный момент. Проверка домашнего задания
Контрольные вопросы: слайд 2
Сформулируйте определение фенолов.
а) замещения атома водорода в гидроксильной группе
б) замещения атомов водорода в бензольном кольце
в) присоединения
Назовите полученные соединения.
- Какие качественные реакции на фенол вам известны?
- Назовите основные области применения фенола.
II. Изучение нового материала.
1. Вступительное слово учителя. Как уксусный альдегид двух химиков поссорил слайд 3
В конце XVIII в. химики интенсивно изучали свойства известных органических соединений. В 1782 г. К. Шееле, окисляя этиловый спирт оксидом марганца (IV) в серной кислоте, заметил, что помимо основного продукта — уксусной кислоты — образовалось еще какое-то резко пахнущее соединение, выделить которое не удалось. В последующие годы новый “кислородный эфир” упоминался в работах А. Фуркруа, Л. Воклена. В 1821 г. Иоганн Вольфганг Дёберейнер окислял этиловый спирт в присутствии платинового катализатора и получил некоторое количество смеси исходного спирта с продуктами его окисления. Многие химики, в том числе и Ю. Либих, сомневались, что в этой смеси содержится неизвестное вещество.
Дёберейнер отправил полученный им образец Ю. Либиху, из которого тот в 1835 г. выделил чистое вещество, содержащее на два атома водорода меньше, чем этанол. Ученый установил его состав (С2Н4О) и объявил, что получил новое вещество, названное Alkohol dehydrogenatus — безводородный алкоголь или сокращенно альдегид. В ответ на претензии И. В. Дёберейнера на приоритет открытия Ю. Либих в характерной ему едкой манере заметил, что тот имеет столько же оснований претендовать на открытие альдегида, сколько ньютоновское яблоко — на открытие закона всемирного тяготения.
Поскольку первый из известных альдегидов содержал два атома углерода, начались попытки получения первого представителя гомологического ряда. Они были неудачными вплоть до 1868 г., когда немецкий химик-органик Август Вильгельм Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О.
2. Строение альдегидов. Номенклатура и изомерия альдегидов и кетонов.
а) Сообщение учащегося по заранее подготовленному материалу с использованием слайда 4.
Альдегиды и кетоны относят к классу карбонильных соединений. Молекулы этих веществ содержат реакционно-способную поляризованную карбонильную группу:
Общая формула для альдегидов и кетонов ![]() – СnH2nO
– СnH2nO
“Отличительными” суффиксами в названиях альдегидов и кетонов служат соответственно -аль и -он.
Альдегидная группа может располагаться только на конце молекулы. Нумерация самой длинной цепи в альдегидах начинается с углерода альдегидной группы, а её положение (цифра 1) как само собой разумеющееся в названии не указывается.
В кетонах же карбонильная группа может находиться и в середине углеродной цепи, поэтому в названии после суффикса -он через дефис указывается её положение. Нумеруют самую длинную цепь в кетонах с того конца, к которому ближе карбонильная группа.
Если, помимо карбонильной группы, соединение содержит двойную или тройную связь, то цифру, показывающую её положение в цепи, удобно ставить до основы названия.
б) отработка навыков номенклатуры альдегидов и кетонов по слайду 5.
2 в) Занимательный материал и номенклатура альдегидов и кетонов. Слайд 6
Насекомые общаются между собой, выделяя ничтожные количества органических соединений, имеющих сравнительно небольшие молекулы. Такие вещества называются феромонами. Феромоны делят на половые, возбуждающие, успокаивающие, сбора, тревоги и другие. Чувствительность насекомых к феромонам просто поразительна: самец ночной бабочки большой павлиний глаз чувствует половой феромон самки на расстоянии до 10 км! Синтетические феромоны используются для борьбы с вредными насекомыми путем заманивания их в ловушки, дезориентации в период спаривания, отпугивания.
Муравьи для подачи сигнала тревоги выделяют два феромона. Формулы этих феромонов вы сейчас видите на экране. Дайте названия этим веществам.
3. Гомологический ряд альдегидов и кетонов.
Подведя итоги всему услышанному и увиденному рассмотрим гомологические ряды альдегидов и кетонов и ещё раз дадим названия рассмотренным веществам. Слайд 7
4. Физические свойства альдегидов и кетонов. Слайд 8
Характеризуя агрегатное состояние и растворимость в воде низших представителей гомологических рядов альдегидов и кетонов, учитель говорит о том, что карбонильная группа также может участвовать в образовании межмолекулярных водородных связей с молекулами воды, но прочность этих связей значительно меньше, чем для спиртов. Поэтому карбонильные соединения имеют меньшие температуры кипения и плавления, чем спирты с соответствующей молекулярной массой:
Отличительной чертой многих альдегидов и кетонов является их запах. Для низших представителей гомологических рядов он резкий и часто неприятный. Высшие альдегиды и кетоны, особенно непредельные или ароматические, входят в состав эфирных масел и содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях. Получается, что мы сталкиваемся с альдегидами и кетонами практически ежедневно!
Демонстрация пищевого ванилина и какое-либо средства бытовой химии с лимонным запахом. Ванилин — это ароматический альдегид, получаемый синтетически, а запах лимона чистящему средству придает синтетический цитраль, по химической структуре являющийся диеновым альдегидом:
Обоняние в мире животных играет часто большую роль, чем зрение или слух. Например, муравьи по запаху могут определить не только форму предмета, но и его твердость. Для многих видов запах — это основная сигнальная система. Человек среди земных “нюхачей” занимает одно из последних мест. Мы часто в прямом и переносном смысле употребляем фразу “нюх как у собаки”. Она не лишена основания: собака улавливает запахи в концентрации, недоступной не только обонянию человека, но и современным приборам. Она, например, может уловить запах масляной кислоты, если в 1 см3 воздуха содержится всего 9000 молекул этого вещества.
Рассчитайте пожалуйста, сколько это составляет по количеству вещества и чему равна масса кислоты.
5. Химические свойства альдегидов и кетонов.
Сообщение учащегося по заранее подготовленному материалу с использованием слайдов 9 - 10
Общие реакции для альдегидов и кетонов — реакции присоединения по карбонильной группе. При этом альдегиды вступают в вышеназванные реакции более активно, чем кетоны.
При гидрировании из альдегидов можно получить первичные спирты, а из кетонов — вторичные.
Реакции присоединения.
1. Гидрирование. Присоединение водорода по кратной связи С = О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий):
R – CHO + H2 ![]() R – CH2 – OH
R – CH2 – OH
R – CH – R1 + H2 ![]() R – CHOH – R1
R – CHOH – R1
В результате образуются спирты соответствующего строения. Это реакция, обратная получению карбонильных соединений из спиртов.
2. Присоединение циановодорода. Альдегиды и кетоны присоединяют по карбонильной группе полярную молекулу синильной кислоты (циановодород). Присоединение идет в соответствии с распределением электронной плотности в реагентах:
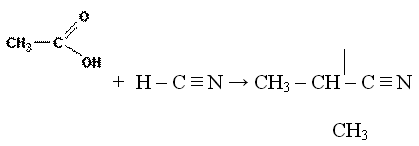
Образующийся продукт реакции относится к классу циан-гидринов (нитрил оксикислоты) и содержит на один атом углерода больше, чем исходный альдегид. Такая реакция применяется для наращивания углеродной цепи в органических молекулах.
Наряду с общими реакциями для альдегидов и кетонов есть и принципиальные отличия в их химическом поведении:
Присоединение гидросульфита натрия. Альдегиды в отличие от кетонов способны присоединять молекулу гидросульфита натрия. Эта важная реакция позволяет не только обнаружить альдегиды, но и выделить их из смеси с другими веществами. Образующиеся сульфопроизводные выпадают в осадок и очень легко разлагаются кислотами с образованием исходного альдегида:
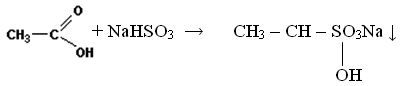
Aльдегиды легко окисляются до соответствующих карбоновых кислот. Кетоны можно окислить лишь в жестких условиях (нагревание с азотной или хромовой кислотами). При этом образуется смесь низкомолекулярных карбоновых кислот и реакция сопровождается деструкцией углеродного скелета
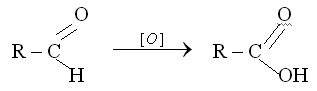
Реакции окисления.
1. Как уже говорилось, альдегиды в отличие от кетонов легко окисляются. Эти реакции используются как в целях органического синтеза, так и для качественного обнаружения альдегидов.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АЛЬДЕГИДЫ слайд 11
Альдегидную группу в органических соединениях можно обнаружить с помощью таких реакций, как взаимодействие со свежеосажденным гидроксидом меди(II) при нагревании,
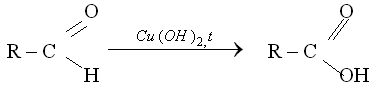
С аммиачным раствором оксида серебра {реакция серебряного зеркала).
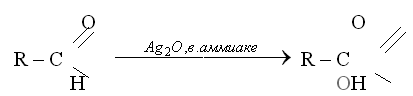
Эти реакции позволяют отличить альдегиды от кетонов.
При взаимодействии альдегида с гидроксидом меди (II) наблюдается образование кирпично-красного осадка оксида меди(I), а в реакции серебряного зеркала на стенках пробирки или колбы, в которой проводится эксперимент, образуется налет металлического серебра.
Впервые эта реакция была предложена немецким химиком Ю. Либихом.
2. Демонстрационный эксперимент. В результате окисления альдегидов образуется новый класс веществ, называемый карбоновыми кислотами. В качестве окислителя можно использовать и кислород воздуха, и неорганические соли (перманганат калия) и даже такие специфические слабые окислители, как аммиачный раствор оксида серебра или гидроксид меди (II).
1. Реакция “серебряного зеркала”
2. Реакция с гидроксидом меди (II).
3. Рассказ учащегося об учёном Ю. Либихе. слайд 12 приложение 2
5. Реакции конденсации. слайд 13
Изучением свойств альдегидов занимался выдающийся русский химик и композитор, автор знаменитой “Богатырской симфонии” и всемирно известной оперы “Князь Игорь” Александр Порфирьевич Бородин. В 1872 г. он обнаружил, что при действии металлического натрия на альдегиды образуются не только продукты их диспропорционирования (спирт и карбоновая кислота), но также вещества с удвоенной : по сравнению с альдегидом молекулярной массой. Детальное исследование необычного продукта привело ученого к выводу, что вещество содержит одновременно и альдегидную, и гидроксильную группы, т. е. является алъдегидоспиртом (альдолем).
По химическому строению альдоль представлял собой продукт присоединения одной молекулы альдегида к другой:
Открытая А. П. Бородиным реакция получила название альдольной конденсации. Она протекает в щелочной среде и широко используется в промышленности для получения синкретического каучука, смол, лаков и душистых веществ.
Рассказ учащегося о А.П. Бородине. слайд 14 приложение 3
6. Подведение итогов по рассмотренному материалу.
В начале работа по ОК, приложение 4, а затем совместная работа по слайду 15
7. Отдельные представители и их применение.
СИНТЕЗЫ НА ОСНОВЕ ФОРМАЛЬДЕГИДА
Сообщение учащегося по заранее подготовленному материалу с использованием слайда 16
Характерные реакции для альдегидов и кетонов — присоединение по реакционно-способной карбонильной группе
![]()
Чем больше поляризована эта группа, тем легче идут реакции присоединения.
Для формальдегида такая тенденция проявляется особенно ярко, так как карбонильная группа в молекуле формальдегида поляризована в наибольшей степени по сравнению с другими членами гомологического ряда альдегидов.
Являясь альдегидом, формальдегид может восстанавливаться до соответствующего спирта (метилового) и окисляться до соответствующей кислоты (муравьиной).
В таблице представлены основные направления органических синтезов на основе формальдегида: получение полимерных материалов (карбамидные и фенолформальдегидные смолы); образование продуктов конденсации формальдегида (триоксан, параформ); синтез взрывчатых веществ (гексоген), лекарственных препаратов (уротропин), первичных спиртов.
Мы упоминули очень интересное соединение — уротропин. Впервые оно было..получено А. М. Бутлеровым в 50-х гг. XIX в. при действии на формальдегид аммиаком. Молекулярная формула вещества (СН2)6N4 определила его химическое название — гексаметилентетрамин. Структура вещества
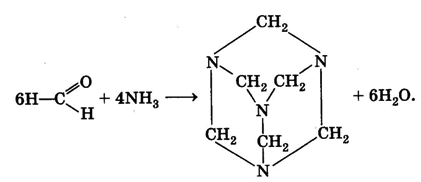
При нагревании в присутствии кислот уротропин вновь разлагается на аммиак и формальдегид. Это его свойство позволяет использовать уротропин в медицине в качестве антисептического средства. В организме человека он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы. На том же свойстве основано применение препарата кальцекс, представляющего собой комплекс уротропина с хлоридом кальция.
Большое количество формальдегида используется для производства фенолоформальдегидных смол. Их смешивают с различными наполнителями и изготавливают пластмассы, называемые фенопластами. При растворении фенолоформаль-дегидных смол в ацетоне или спирте получают лаки/
При взаимодействии формальдегида с карбамидом {мочевиной) (NН2)2СО получают карбамидную смолу, а из нее — амино-пласты. Из этой пластмассы изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звукоизоляционные пористые материалы.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
8. Закрепление.
Чтобы проверить как вы усвоили материал и ещё раз закрепить полученные знания я предлагаю вам разгадать кроссворд по теме “Альдегиды и кетоны”. слайд 17 приложение 5
9. Подведение итогов.
10. Домашнее задание. § 19, самостоятельно разобрать способы получения (ОК на доске). № 2,3, 4(задача), № 11*
Используемая литература:
- О.С.Габриелян “Химия-10”.
- О.С.Габриелян, И.Г.Остроумова. “Настольная книга учителя химии. 10 класс”.
А.А.Карцова, А.Н.Лёвкин “Органическая химия. Иллюстрированный курс”.
Предлагаемая к уроку презентация имеет достаточно большой объём и в случае не размещения её на сайте учитель поделиться данной презентацией по электронной почте, если вы обратитесь по адресу: Lysokon22@mail.ru