Тип урока: обобщающий урок.
Цели урока:
- Образовательные: формирование целостного представления о составе, строении, свойствах и применении основных классов углеводородов на основе их сравнительной характеристики.
- Воспитательные: воспитание дисциплинированности и самостоятельности в процессе усвоения и применения знаний в нестандартных ситуациях, ответственности за результаты учебного труда.
- Развивающие: развитие интереса к предмету, творческих способностей, внимания, аналитических навыков.
Предполагаемые результаты урока: учащиеся должны знать основные характеристики важнейших классов углеводородов; уметь прогнозировать состав, строение и свойства представителей классов, составлять генетические связи между разными классами углеводородов, а также связывать неорганические вещества с органическими.
Оборудование: ПК, проектор, экран, мультимедийная презентация «Углеводороды», коллекция веществ «Углеводороды», ИОП «Генетическая связь углеводородов».
ХОД УРОКА
I. Организационный момент
II. Вступительное слово учителя. Сегодня на уроке мы подведем итоги изучения темы «Углеводороды». Количество органических веществ, содержащих в своём составе атомы двух химических элементов – углерода и водорода, очень велико. Мы рассмотрели лишь наиболее важные классы углеводородов и основные закономерности, описывающие их состав, строение и свойства. (Приложение 1).
Вопрос: Какие вещества называются
углеводородами?
(Ответ учащихся: углеводороды – это органические
соединения, состоящие из углерода и водорода)
Вы изучили все классы углеводородов. Сегодня
проведем обобщающий урок по этой теме.
Вопрос: как вы думаете, какова цель нашего урока?
(высказывания учащихся)
Цель нашего урока – повторить, обобщить и закрепить полученные знания и умения по теме «Углеводороды» изучить многообразие их, а также генетическую связь углеводородов. (Приложение 1).
Разнообразный мир углеводородов можно
разделить на три группы: предельные,
непредельные, циклические. А какие представители
этих групп Вам известны? Основные физические
свойства? (демонстрация коллекции)
К предельным углеводородам относятся алканы, к
непредельным – алкены, алкадиены, алкины, к
циклическим – циклоалканы, арены. (Приложение
1).
А какое практическое значение имеют эти вещества? (Приложение 1).
Углеводороды играют важнейшую роль в нашей жизни: служат сырьем для получения пластмасс, резины, лекарств, волокон, средств бытовой химии, несут в наши дома свет и тепло.
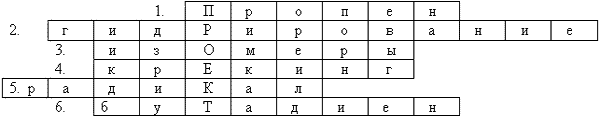
III. Решение кроссворда (Приложение 1).
1. Название алкена, состоящего
из трех атомов С.( пропен)
2. Название реакции
присоединения водорода. ( гидрирование)
3. Вещества, имеющие одинаковый
количественный состав, но отличающиеся по
строению и свойствам называют… (изомеры)
4. Название термического
разложения нефтепродуктов, приводящего к
образованию углеводородов с меньшим числом
атомов С в молекуле. ( крекинг)
5. Название частицы, имеющей
неспаренный электрон. ( радикал)
6. Углеводород с двумя двойными
связями, имеющий формулу С4Н6.
IV. Работа в группах – проектное задание по теме «Углеводороды» (составление презентации).
(4 группы: 1. алканы; 2. алкены; 3. алкины, алкадиены; 4. арены и циклоаклканы.)
1. Распределить класс на 4 группы.
2. Каждая группа выбирает определённый класс
углеводородов (возможно, этот класс не изучается
в курсе школьной химии.).
3. Группа согласует свой выбор с учителем.
4. Приступает к выполнению задания.
План выполнения.
1. Общая характеристика класса (общая формула,
определение, особенности класса
углеводородов)
2. Выберите конкретный углеводород –
представитель класса и дайте его характеристику
по показателям:
- Название вещества, его молекулярная, структурная формула.
- Название класса, особенности строения, общая формула, вид гибридизации атома углерода, валентный угол, пространственное строение.
- Изомерия.
- Нахождение в природе
- Физические свойства.
- Химические свойства:
а) реакция горения
б) реакция замещения
в) реакция присоединения
г) другие свойства - Способы получении в промышленности и лаборатории.
- Области применения.
Рекомендации по работе группы: четко распределите роли и обязанности каждого члена группы. Приветствуется использование ИКТ, нестандартная форма представления материала, творчество.
Выступление от группы 3-5 минут.
В ходе урока нужно выполнять ИОП (заполнение таблицы, составление генетических цепочек – Приложение 2), используя опорные таблицы и взаимосвязи углеводородов. (Приложение 1).
V. Индивидуальное задание решение поурочного теста
Тема «Углеводороды»
Начало формы
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
|
||||||||||
Конец формы |
V. Подведение итогов
Выставление оценок.
V. Домашнее задание
ИОП составление и решение генетических цепочек (рисунок 1, рисунок 2): черные задания на 3, зеленые задания на 4, красные задания на 5.