Известно, что элементарные молекулярно-кинетические и энергетические представления о тепловых явлениях закладываются уже на первой ступени обучения физики – ознакомление в 7 классе с первоначальными сведениями о строении вещества и использование этих сведений в 8 классе для объяснения тепловых явлений, введение в 8 классе понятия температурных изменений и агрегатных превращений вещества.
В 8 классе учащимся предлагается для изучения курс химии. В начальном курсе химии закладывается базовый материал, который применяется на протяжении всех лет обучения, как на уроках химии, так и на уроках физики. Такие понятия, как относительная атомная масса, относительная молекулярная масса, количество вещества, моль, молярная масса, число Авогадро, молярный объем, нормальные условия, должны на уроках отработаны учителями химии с учащимися так качественно, чтобы при изучении тем «Молекулярная физика», «Термодинамика» в 10 классе больше времени уделялось на углубление и применение имеющихся знаний.
Очень удачно для введения во второй четверти темы «Электрические явления» в 8 классе используется уже изученный материал на уроках химии, который дает сведения о строении атомов, о составе ядер, о существовании ионов. Межпредметная связь физики и химии прослеживается и при изучении электролиза, радиоактивности, металлов и неметаллов, свойств жидкостей, твердых тел и газов и т.д.
Желательно и во внеурочное время развивать интерес к изучению естественно-научного блока через совместно проводимые семинары, факультативы, кружки, брейн-ринги, интеллектуальные марафоны, составление и разгадывание кроссвордов, решение экспериментальных задач на смекалку и т.д.
Например, нужно определить давление внутри перегоревшей электрической лампочки, если разрешено использовать наполненную водой кастрюльку и весы с набором гирь.
Ответ: прежде всего, осторожно удалив цоколь лампочки, взвесим ее. Пусть масса лампочки равна М1. Затем погрузим лампу целиком под воду и обломим кончик штенгеля. Когда вода перестанет поступать в колбу и незаполненным водой останется только пространство, занятое газом, сжатым до атмосферного давления Ро, вынем лампу из воды и вновь определим ее массу – М2. Заполним теперь лампу целиком и вновь определим массу – М3. Разность М3-М1 дает массу воды, целиком заполняющей колбу лампы. Разделив эту разность на воды, мы найдем внутренний объем лампы, т.е. объем газа при искомом давлении Р. Разность М3-М2, деленная на плотность воды, даст объем того же газа при атмосферном давлении Ро.
Считая, что во время сжатия газа его температура не меняется, можем записать на основании закона Бойля-Мариотта:
Отсюда искомое давление равно
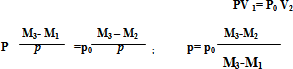
При изучении теоретического материала необходимо показывать связь наук через использование общих базовых определений, формул, решение задач.
Если провести опрос среди учащихся по выявлению качества усвоения такого понятия как «движение», то выясняется, что знания о движении в сознании многих остается на уровне механических представлений, лишь немногие вспомнят о тепловом движении. Поэтому знания, получаемые учащимися в выпускных классах, должны быть систематизированы и обобщены.
В качестве дополнительных вопросов к содержанию общего курса химии в средней школе рекомендую обратить внимание на темы, изучаемые в 10 классе по физике «Уравнение состояния идеального газа. Газовые законы.» и востребованные учителями химии при подготовке учащихся к предметным олимпиадам и поступлении в ВУЗы.
Для того чтобы облегчить учащимся усвоение и систематизацию данного материала, полезно изучать газовые законы по единообразной, например следующей, системе:
- Название процесса.
- Постоянная величина.
- Формула.
- Графики.
- Объяснение закона на основе МКТ газов.
- Примеры практического применения закона.
- Решение задач.
Экспериментальные газовые законы были открыты опытным путем независимо друг то друга и описывают поведение фиксированной массы газа, когда один из параметров температура, давление или объем поддерживается постоянным, т.е. относятся к так называемым изопроцессам. Это процессы в которых каждое промежуточное состояние является равновесным и их можно провести в обратном направлении через ту же последовательность состояний, т.е. они обратимы.
![]()
Графики изотермического процесса – изотермы – представляют собой в координатах (P, V) гиперболы, причем чем больше температура газа, тем выше расположена изотерма. Эта зависимость позволяет создать термометр с идеальным газом в качестве термометрического тела. Для идеального газа границы применимости закона Бойля-Мариотта связаны с собственным объемом молекул, а для реального газа – с их взаимодействием.
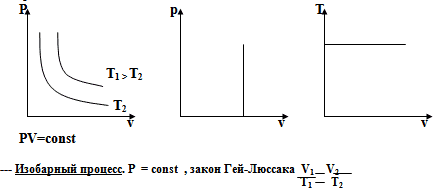
Графики изобары в осях (V, T) представляют собой прямые, выходящие из начала координат, причем для данной массы газа, большему давлению соответствует более низкая изобара. Т.к. все изобары выходят на оси температур из точки -273°С, то для удобства смещают начало отсчета влево на -273 градуса путем введения абсолютной температуры Т=0К. Этот шаг является условным: закон Гей-Люссака перестает выполнять гораздо раньше, что объясняется в рамках МКТ таким уменьшением кинетической энергии молекул, что влияние межмолекулярного взаимодействия становится заметным. Фактически реальные газы при низких температурах переходят в жидкое, и даже твердое состояние. Поэтому линии графиков в области низких температур проводят пунктирной линией, которая справедлива только для идеального газа.
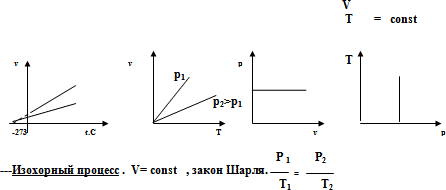
Изохоры идеального газа – прямые, выходящие из начала координат в осях (р,V), причем большему объему соответствует меньшее давление и, соответственно, более низкая изохора.
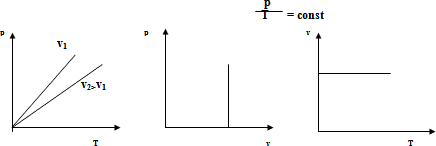
Анализ графика изохорного процесса аналогичен анализу изобары. Необходимо обратить внимание на то, что объем идеального газа при температуре -273°С не может быть равен нулю, поскольку в модели газа молекулы идеального газа наделяются массой и, следовательно, объемом.
При закреплении материала сначала решаются простые тренировочные задачи, позволяющие закрепить изученные формулы. Далее уделяют внимание графическим задачам, в которых требуется один и тот же процесс изобразить в различных координатных осях.
Задача 1.
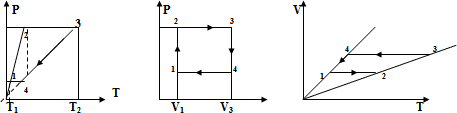
На рисунке в координатах (Т;р) указан цикл, происходящий с 1 моль идеального газа. Построить данный замкнутый цикл на координатных плоскостях (р; V ) и (V ;Т).
Опишем замкнутый цикл 1 -2-3-4-1 в газе на отдельных участках:
1-2 (изохорическое нагревание), т.к. Р увел., Т увел., V= const
2-3 (изобарическое нагревание), Р =const, увел.(угол наклона меньше),
3-4 (изохорическое охлаждение), т.к. Р умен., Т умен., V=const
4-1 (изобарическое охлаждение), т.к. Р=const, V умен. (угол наклона больше), Т умен..
Изобразим данный замкнутый цикл на координатных плоскостях.
Задача 2.
В баллоне находилось некоторое количество газа при нормальном атмосферном давлении. При открытом вентиле баллон был нагрет, после чего вентиль закрыли, и газ остыл до температуры 283 К, при этом давление в баллоне упало до 70 кПа. На сколько нагрели баллон?
Решение. Запишем для двух состояний газа закон Шарля:
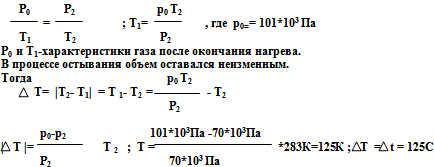
Задача 3.
Плотность пара некоторого соединения углерода и водорода равна 2,5 кг /м3
При температуре 283 К и давлении 101 кПа. Какова молекулярная формула этого соединения?
Решение. Запишем уравнение Менделеева-Клапейрона и формулу для определения плотности.

Молярная масса углерода составляет 0,012 кг/моль, водорода – 0,001 кг/моль. Отсюда следует, что формула данного соединения углерода и водорода имеет вид С4Н10.
Задача 3.
Сколько электронов заключается в 1 л кислорода при давлении 1 МПа и температуре 473 К?
Решение. Будем считать, что кислород находится в молекулярном состоянии. В формуле Менделеева-Клапейрона отношение массы газа к молярной массе есть количество вещества. С другой стороны количество вещества есть отношение числа молекул к числу Авогадро
![]()
Число электронов найдем из соотношения N'=16N. Где 16 – число электронов в одной молекуле кислорода.
Вычислим результат:
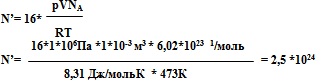
Задача 4.
В баллоне объемом V= 10-2 м3 содержится при температуре Т=293 К водород под давлением р = 10 МПа. Сколько водорода было потеряно, если при сжигании оставшегося водорода образовалась вода массой 0,5 кг?
Решение. Запишем уравнение химической реакции сгорания водорода и найдем соотношение между массами водорода и воды:
![]()
Масса вступающего в химическую реакцию водорода в 9 раз меньше массы продукта реакции - воды. Отсюда следует вывод. Что для получения 0,5 кг воды необходимо использовать 0,5 / 9 кг водорода.
Определим массу водорода, содержащего в баллоне:

Задача 5.
Шар объемом 1 м3 наполнен гелием при температуре Т1=300 К и давлении р1= 120 кПа. Определите высоту, на которой шар будет находиться во взвешенном состоянии, если его оболочка имеет массу m0 =0,3 кг и при подъеме на высоту ![]() =100м давление воздуха падает на p=1,33 кПа, а температура понижается на T= 0,54 К. Атмосферное давление у поверхности земли нормальное.
=100м давление воздуха падает на p=1,33 кПа, а температура понижается на T= 0,54 К. Атмосферное давление у поверхности земли нормальное.
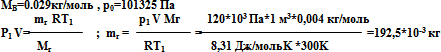
Решение. Определим массу гелия в шаре.
Вес шара равен Р1 = (mг+m0) g ;
Шар будет находиться в равновесии при условии, что его вес будет равен весу воздуха в объеме шара. Т.е.
(mг+m0)g= mвg
mг+m0 =mв
mв – масса воздуха в объеме шара на высоте, р – давление и Т – температура на этой высоте.
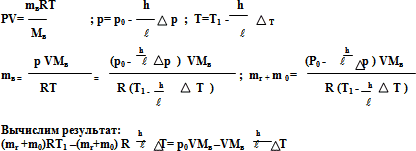

Говоря о затруднениях учащихся при решении задач углубленного курса физики и химии, нельзя обойти задачи, связанные с давлением смеси газов. В учебниках лишь кратко рассматривается информация, что атмосферный воздух представляет собой смесь различных газов и водяного пара и что каждый из газов вносит свой вклад в суммарное давление, производимое воздухом на находящие в нем тела. Вводится в углубленном изучении курса понятие парциального давления газа, входящего в состав газовой смеси, которое он производил бы, если бы он один занимал весь предоставленный объем смеси и находился при температуре смеси.
На основании этого определения парциальные давления составляющих смесь газов вычисляются по формулам:
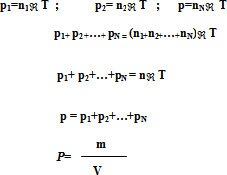
Из уравнения Менделеева-Клапейрона
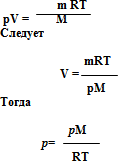
p – давление, М – молярная масса, R – универсальная газовая постоянная, Т – температура
Формула применима, разумеется, и к смеси, так как смесь идеальных газов тоже представляет собой идеальный газ.
Найдем теперь молекулярную массу смеси газов. Пусть р1 и р2 – парциальные давления кислорода и азота соответственно, V – объем смеси, Т – ее температура .
Тогда согласно уравнению Менделеева-Клайперона, имеем:

Так как для смеси газов справедливо уравнение закона Дальтона, где m1+ m2 – масса смеси, то на основании уравнений, получим:
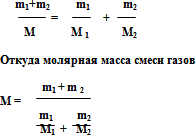
Подставив это выражение в формулу плотности, найдем плотность смеси:
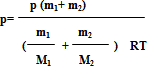
Выразим значения заданных величин в единицах СИ : m1 =64* 10-3 кг,
m2 = 56*10-3 кг
Т =27+273=300 К
R= 8.31 Дж/моль К, Подставив в формулу,числовые значения и произведя вычисления ,получим p= 1,2 кг/ м3
Нетрудно показать, что в случае смеси N различных газов молярная масса смеси
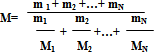
При решении задач по молекулярной физике и газовым законам учащиеся допускают ошибки и проявляют свое неумение применять знания для анализа конкретной задачи. Поэтому наша задача научить учащихся учиться!
УДАЧИ И УСПЕХОВ ДОРОГИЕ УЧИТЕЛЯ!!!
Литература.
- Бергер Н.М. Изучение тепловых явлений в курсе физики средней школы: пособие для учителей. Из опыта работы.- М.: Просвещение, 1981.
- Зеленин С.П. Готовимся к экзамену по физике. Молекулярная физика и термодинамика. - СПб.: Издательство С.-Петербургского университета, 1996.
- Игропуло В.С., Вязников Н.В. Физика: алгоритмы, задачи, решения: Пособие для всех, кто изучает и преподает физику. – М.: Илекса, Ставрополь: Сервисшкола, 2004.
- Мякишев Г.Я. Физика: Молекулярная физика. Термодинамика. 10 кл.: Учеб. Для углубленного изучения физики, (Г.Я, Мякишев, А.З.Синяков) 5 изд., стереотип.- М.: Дрофа, 2002.
- Савченко Н.Е. Задачи по физике с анализом их решения.-М.: Просвещение, 2000.