Цели. На основе интеграции исторических, биологических и химических знаний изучить нахождение фосфора в природе и его свойства, вскрыть причинно-следственные связи “строение - свойства” и “свойство - применение”, установить связь науки с практикой – выяснить значение фосфора для человека.
Задачи:
Образовательные:
- Расширить знания учащихся о неметаллах на основе изучения элемента фосфора и его соединений.
- Продолжить формирование умений прогнозировать свойства простого вещества на основе положения химического элемента в Периодической системе химических элементов.
- Познакомить учащихся с получением, свойствами и применением фосфора.
- Продолжить формирование умения и навыка составления окислительно-восстановительных реакций с использованием метода электронного баланса.
- Способствовать формированию устойчивого интереса к изучаемому предмету, используя исторические хроники, презентации на уроке, а также самостоятельно подготовленные сообщения учащихся.
Развивающие:
- На основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ.
- Продолжить формирование умений работать в темпе, экономя время урока.
Воспитательные:
- Показать значимость химических знаний для современного наукоемкого производства и успешной адаптации будущих специалистов в обществе.
- Показать роль химической науки и практики в развитии народного хозяйства страны.
Тип урока: комбинированный. Сообщение новых знаний и их совершенствование.
Оборудование и реактивы: коллекция природных материалов, коллекция фосфорных удобрений, таблица “Строение фосфора”, Периодическая система химических элементов Д.И.Менделеева: спиртовка, ложечка для сжигания, красный фосфор, колба наполненная кислородом, индикатор (метил.оранж.), мультимедийный проектор.
Ход урока
1. Организационный момент
2. Вступительное слово учителя
(Слайд 1, см. Приложение 1):
“Чудовище лежало перед нами…
Его огромная пасть все еще светилась голубоватым
пламенем, глубоко сидящие дикие глаза обведены
кругами. Я дотронулся до этой светящейся головы
и, подняв руку, увидел, мои пальцы тоже
засветились в темноте.
– Фосфор, – сказал я”.
Тема урока – ФОСФОР. Учащимся сообщаются цели урока.
3. Изучение нового материала
1. Нахождение фосфора в природе (рассказ учителя)
Фосфор – один из самых распространённых элементов земной коры, его содержание составляет 0,08–0,09 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3* СаХ2 (Х=F,Cl,OH) (слайд №2), фосфорит Ca3(PO4)2 и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах фосфолипиды. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений АТФ, является элементом жизни.
2. История открытия фосфора
Заранее подготовленный учащийся делает сообщение:
“Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, а получил светящееся вещество (слайд №3). Несколько позже фосфор был получен другим немецким химиком – Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р.Бойлем, описавшим его в статье “Способ приготовления фосфора из человеческой мочи”, датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать еще арабские алхимики в XIIв. То, что фосфор – простое вещество, доказал Лавуазье.”
“Происхождение названия”
Заранее подготовленный учащийся делает сообщение:
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала “холодным огнём”. Вторичное название “фосфор” происходит от греческих слов “фос”– свет и “феро”– несу. В древнегреческой мифологии имя Фосфор (или Эосфор, греч. Цюуцпспт) носил страж Утренней звезды.”
3. Получение:
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С (слайд 4):
Учащиеся совместно с учителем записывают уравнение химической реакции, расставляют коэффициенты методом электронного баланса, указывают окислитель и восстановитель(слайд 5):
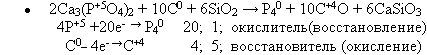
Образующиеся пары белого фосфора конденсируются в приёмнике под водой.
Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту (один из учащихся работает у доски, записывает уравнение химической реакции, расставляет коэффициенты методом электронного баланса, указывает окислитель и восстановитель) (слайд 6):
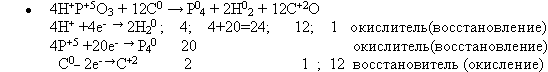
4. Изучение строения атома фосфора
Учащимся дается задание по Периодической системе сравнить строение атома фосфора с атомом азота. (слайд 7)
Ученики самостоятельно по Периодической системе рассматривают и делают выводы: атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Записывают на доске электронную формулу атома фосфора. Делают выводы: минимальная степень окисления фосфора -3 (встречаются реже, чем у азота Са3Р2, Ма3Р), максимальная степень окисления фосфора +5 (Н3РО4, Р2О5). В отличие от азота, за счет имеющегося в атоме фосфора, на третьем энергетическом уровне, d-подуровня возможно “распаривание” электронов и валентность, которую может проявлять фосфор равна пяти.
Учитель дополняет, что соединение фосфора с водородом – ф о с ф и н РН3 – тот редкий случай, когда ковалентная связь между атомами разных элементов неполярна в силу того, что электроотрицательности фосфора и водорода имеют почти одинаковые значения.
5. Физические свойства фосфора:
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций. Обычно выделяют четыре модификации простого вещества – белую, красную, черную и металлический фосфор. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений – также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств(слайд 8)
Белый фосфор ( сообщение учащегося) представляет собой белое вещество, Тп= 44,1°С. По внешнему виду он очень похож на парафин, легко режется ножом. Химически белый фосфор чрезвычайно активен. Например, белый фосфор медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией. Белый фосфор весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей) и легкорастворим в органических растворителях.
Неочищенный белый фосфор обычно называют “жёлтый фосфор”. Сильноядовитое ПДК 0,03 мг/м?), огнеопасное кристаллическое вещество. Горит ослепительным ярко-зеленым пламе-нем с выделением густого белого дыма – мелких частичек декаоксида тетрафосфора P4O10.
Для предохранения от самовозгорания желтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор, также называемый фиолетовым фосфором в первые был получен в 1847 году в Швеции австрийским химиком А.Шрёттером при нагревании белого фосфора при 500°С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу (Р4)n и представляет собой полимер со сложной структурой. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков).
Чёрный фосфор – это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника.
Металлический фосфор: При 8,3·1010 Па чёрный фосфор переходит в инертную металлическую фазу и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см?. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота.
А) Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом (слайд 9):
Учитель показывает в вытяжном шкафу опыт “горение фосфора”. Учащиеся самостоятельно записывают уравнения химических реакций, расставляют коэффициенты методом электронного баланса, указывают окислитель и восстановитель. Первый справившийся с заданием ученик помогает напарнику. В классе осуществляется взаимопроверка. (слайд 10)
- 4P + 5O2
 2P2O5
(с избытком кислорода)
2P2O5
(с избытком кислорода) - 4P + 3O2
 2P2O3
(при медленном окислении или при недостатке О2).
2P2O3
(при медленном окислении или при недостатке О2).
Фосфор взаимодействует с металлами как окислитель, образует фосфиды (слайд 11):
- 2P + 3Ca
 Ca3P2,
Ca3P2, - 2P + 3Mg
 Mg3P2.
Mg3P2.
с неметаллами как восстановитель (слайд 12):
- 2P + 3S
 P2S3,
P2S3, - 2P + 3Cl2
 2PCl3.
2PCl3.
Не взаимодействует с водородом.
В) Взаимодействие со сложными веществами:
Взаимодействует с водой, при этом диспропорционирует (является и окислителем и восстановителем) (слайд 13):
- 4Р0 + 6Н2О
 Р-3Н3
+ 3Н3Р+1О2 (фосфатная кислота.
Р-3Н3
+ 3Н3Р+1О2 (фосфатная кислота.
P0 +3e- Р -3 окислитель
(процесс восстановление)
Р -3 окислитель
(процесс восстановление)
P0 -e- Р +1 восстановитель
(процесс окисление)
Р +1 восстановитель
(процесс окисление)
В растворах щелочей диспропорционирование происходит в большей степени (слайд 14):
- 4Р0 + 3KOH + 3Н2О
 Р-3Н3
+ 3KН2Р+1О2.
Р-3Н3
+ 3KН2Р+1О2.
P0 +3e- Р -3 окислитель
(процесс восстановление)
Р -3 окислитель
(процесс восстановление)
P0 -e- Р +1 восстановитель
(процесс окисление)
Р +1 восстановитель
(процесс окисление)
Сильные окислители превращают фосфор в фосфорную кислоту (слайд 15):
- 3P 0 + 5HN+5O3 + 2H2O
 3H3P +5O4 + 5N+2O;
3H3P +5O4 + 5N+2O;
P0 -5e- Р +5 восстановитель
(процесс окисление)
Р +5 восстановитель
(процесс окисление)
N+5 +3e- N +2 окислитель (процесс восстановление)
- 2P + 5H2SO4
 2H3PO4
+ 5SO2 + 2H2O.
2H3PO4
+ 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P + 5KClO3
 5KCl + 3P2O5
5KCl + 3P2O5
7. Применение фосфора
Заранее подготовленный учащийся делает сообщение
Область применения соединений фосфора огромна (слайд 16) . Определение А.Е.Ферсмана: “Фосфор – элемент жизни…” находит повсеместное подтверждение. Фосфор – элемент не только биологической жизни, но и повседневной, действительно, фосфорсодержащие соединения используются в сельском хозяйстве, медицине, фармакологии, научных исследованиях, пищевой и химической промышленности, строительстве, металлургии, технике и, наконец, в повседневном быту. Такая ситуация была не всегда, и на протяжении долгого времени после открытия Бранда фосфор оказывался замешанным во многих скверных историях, все началось со спекуляций самого Бранда и его последователей. Далее “таинственные” вспыхивающие надписи на стенах в храмах и “чудо самовоспламенения свечей”. Долгое время бытовали предрассудки и суеверия, связанные с “блуждающими” огнями, возникающими иногда над болотами и являющимися следствием самовоспламенения фосфина.
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка. При трении спичечной головки в состав который входят хлорат калия и сера, происходит воспламенение
Большинство (80–90%) добываемой фосфатной руды идет на получение удобрений. В 1799 было доказано, что фосфор необходим для нормальной жизнедеятельности растений. Накапливаясь в биомассе, фосфор исчезает из почвы. Ежегодно мировой урожай уносит с полей несколько миллионов тонн фосфора, наряду с азотом и калием, поэтому необходимо возобновление его ресурсов в плодородном слое. В древние времена люди удобряли почву навозом, костями и гуано. Первое искусственное фосфорное удобрение – суперфосфат – было получено в Англии в 1839 Лаузом, а в 1842 там же было организовано его первое промышленное производство. В России первое предприятие по производству суперфосфата появилось в 1868. Сейчас его получают, обрабатывая апатит серной кислотой:
Ca10(PO4)6F2 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF.
Побочно получающийся сульфат кальция не отделяют.
Более ценный продукт – двойной суперфосфат, так как в нем содержится в три раза больше фосфора по массе, его получают обработкой апатита фосфорной кислотой:
Ca10(PO4)6F2 + 14H3PO4 +10H2O = 10Ca(H2PO4)2·H2O +2HF.
Доля производства удобрений, содержащих в своем составе только один фосфор, падает, и все больше производится комплексных удобрений, содержащих два или три питательных элемента. Большая часть фосфорных удобрений, производимых в России, приходится на аммофос, диаммофос и азофоску. Ежегодное мировое производство фосфорных удобрений на начало 21 в. составило 41 млн. тонн, а суммарное количество всех удобрений – 190 млн. тонн. Основными производителями фосфорных удобрений являются Марокко, США и Россия, а основными потребителями – страны Азии, Латинской Америки и Западной Европы.
4. Закрепление (фронтальный опрос)
– Отрывок из какой книги прозвучал в начале
урока?
– Кто автор?
– Каковы аллотропные модификации фосфора?
– С какими физическими свойствами фосфора мы
познакомились?
– Перечислите химические свойства фосфора.
– Какие области применения имеет фосфор?
5. Заключение
Подведение итогов урока.
6. Домашнее задание
Дома §29 (И.И.Новошинский) (творческие задания: составить презентацию по теме “Соединения фосфора”, кроссворд).