Цель урока: активное повторение пройденного материала по теме “Состояние электрона в атоме. Периодическая система химических элементов Д.И. Менделеева” и использование полученных знаний в новых условиях, развитие творческого химического мышления.
Первая часть урока предполагает повторение основных понятий темы, выполнение “подготовительных” упражнений (определение квантовых чисел по формуле электрона, установление порядка заполнения атомных орбиталей электронами, определение структуры периодической системы и т.п.).
Во второй части занятия проводится игра “Путешествие в параллельный мир”. Суть игры заключается в следующем. Структура квантовых чисел немного искажается. Класс строит на основе новых значений квантовых чисел периодическую систему параллельного мира и выполняет задания по составлению химических формул веществ и написанию уравнений реакций. Игра будет удачной в том случае, если меняется только один параметр, не требующий дополнительных допущений по взаимосвязи квантовых чисел и уровней энергии. Игра может быть проведена на спаренном уроке (2 часа) в 11 классе химико-биологического или физико-математического профиля после изучения темы “ПСХЭ Д.И. Менделеева” или во внеурочное время в виде соревнования команд.
Данный урок разработан на основе исследовательской работы “ПСХЭ Д.И. Менделеева”, выполненной учащимся физико-математического класса Васильевым Антоном (выпускник МОУ СОШ №43 г. Твери 2004 года).
Ход урока
1. Организационный момент (слайды №№1-2)
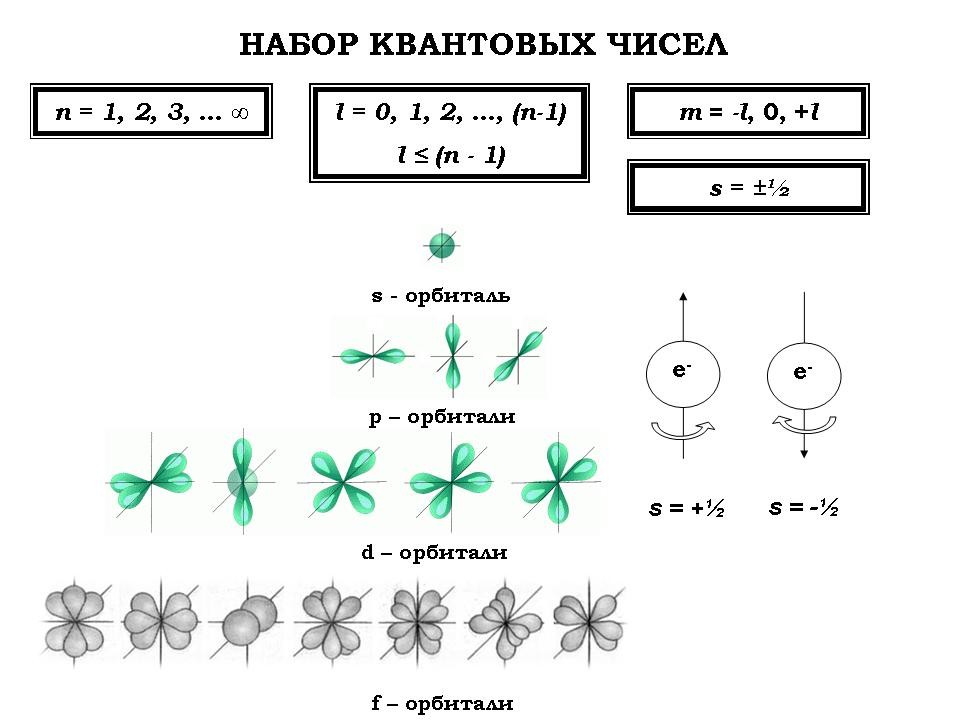
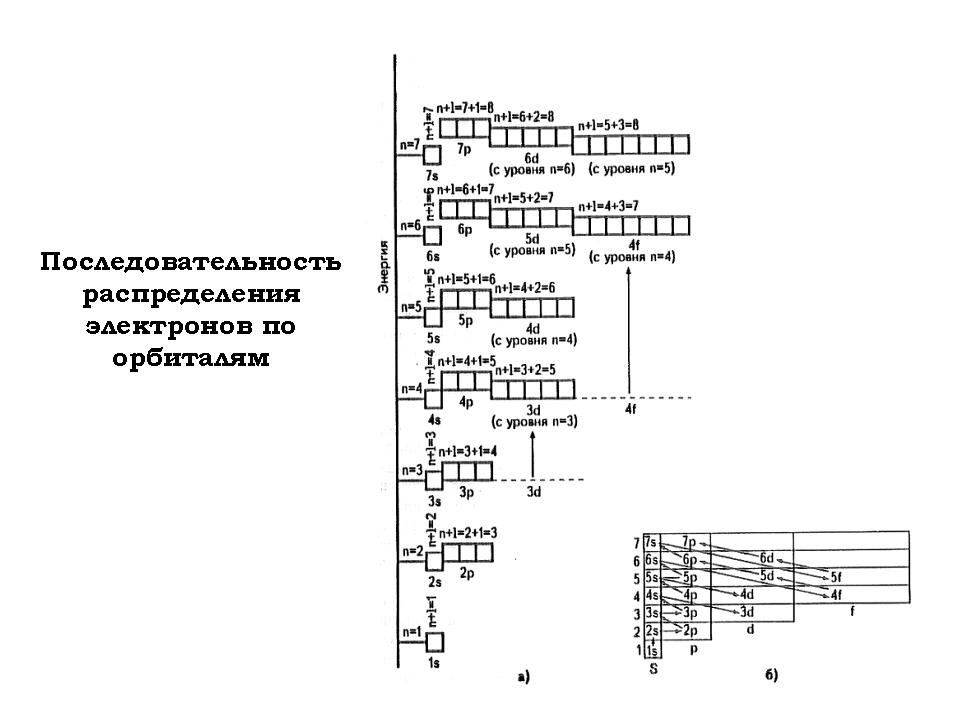
2. Повторение темы “Квантовые числа” (фронтальная работа; слайд №№3-4)
Для повторения теоретических вопросов, изложенных на предыдущих уроках (см. Приложение 1) учащимся предлагается серия упражнений.
3. “Подготовительные” упражнения (работа у доски письменно или устная фронтальная беседа). Тексты заданий напечатаны, находятся на столах учащихся.
n |
4 |
6 |
7 |
3 |
l |
3 |
1 |
0 |
2 |
m |
-2 |
0 |
0 |
2 |
s |
-1/2 |
+1/2 |
-1/2 |
-1/2 |
Электронная формула е- |
? |
? |
? |
? |
Электронная формула е- |
4f13 |
5d7 |
6s1 |
4p4 |
3d2 |
n |
? |
? |
? |
? |
? |
l |
? |
? |
? |
? |
? |
m |
? |
? |
? |
? |
? |
s |
? |
? |
? |
? |
? |
4. Игра “Путешествие в параллельный мир” (слайд №5).
Предлагается решить задачу, которая в свое время была предложена как олимпиадное задание на Всесоюзной олимпиаде по химии в 1969 году под общим названием “Путешествие в параллельный мир”.
Модифицированный вариант задания представлен ниже:
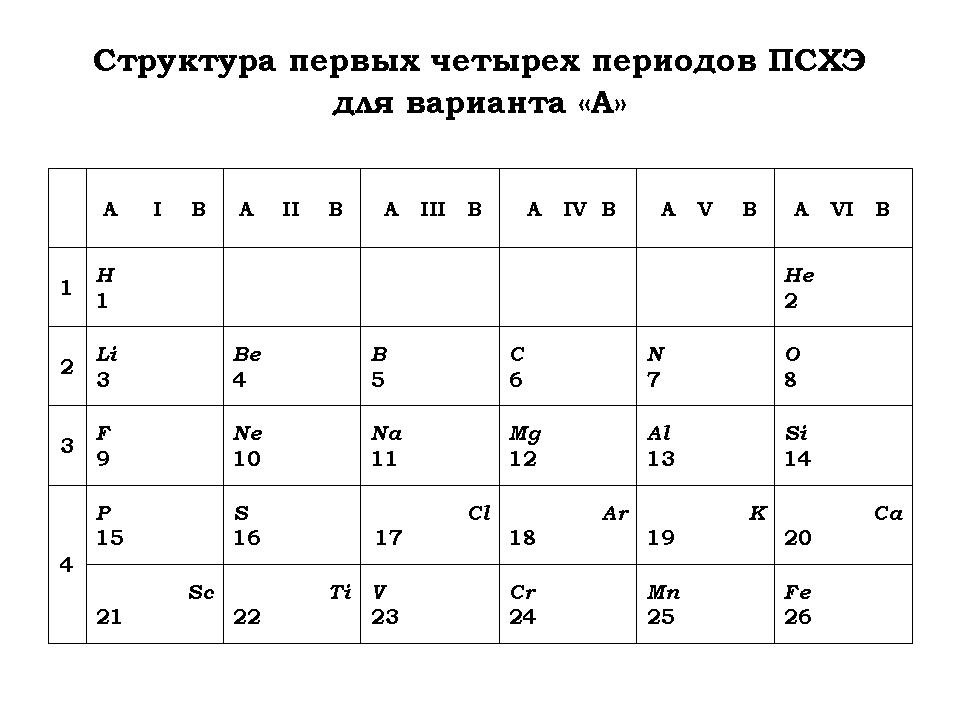
Возможно во Вселенной существуют другие миры, в которых жизнь определяется отличным от земного набором квантовых чисел. Представьте, что вы попали на планету хемозоидов, где все квантовые числа такие же как и на Земле, кроме одного. Допустим:
а) m=0, +l
b) l=0, 1, 2, ...n
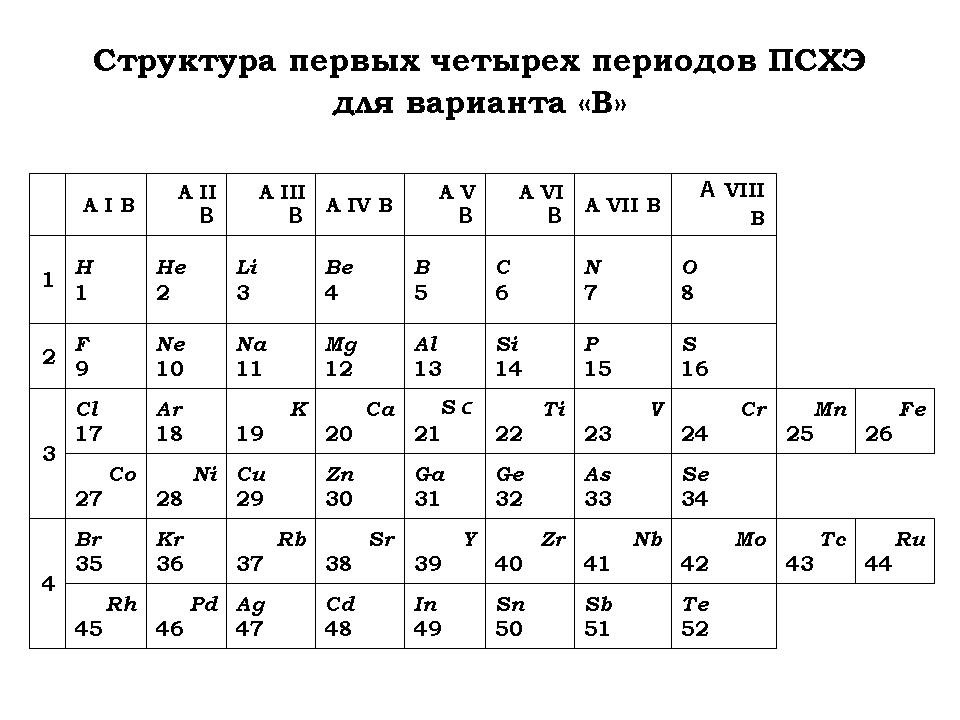
- Как изменится структура ПСХЭ (названия “новых” химических элементов оставить такими же, как в ПСХЭ Д. И. Менделеева в соответствии с порядковыми номерами)?
- Составить схемы заполнения электронами первых четырех периодов.
- Предсказать общее число химических элементов, содержащихся в первых девяти периодах их периодической системы.
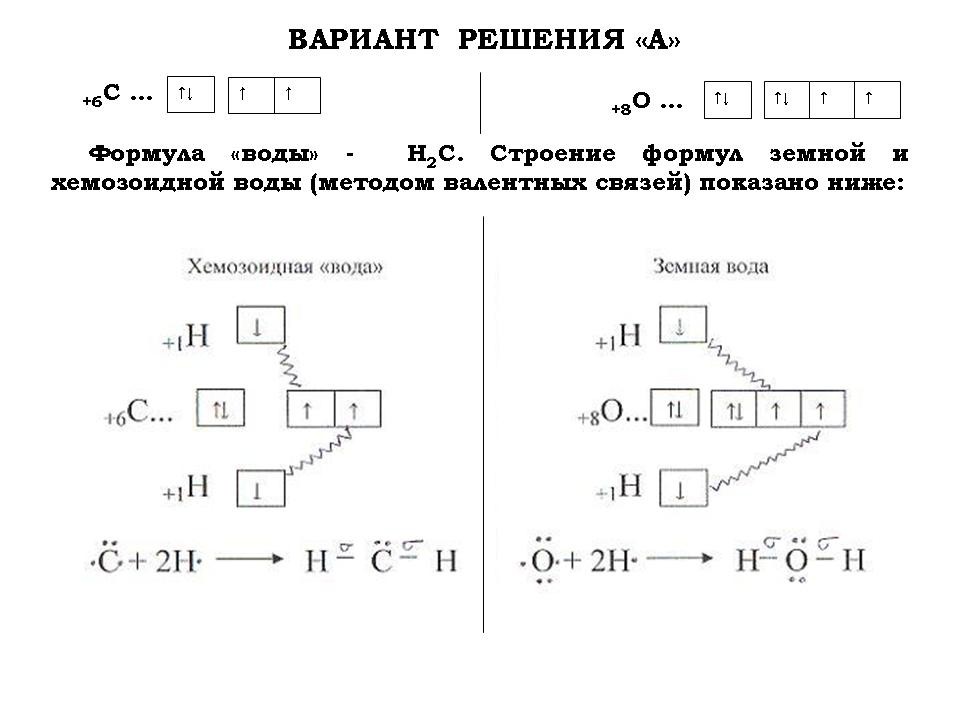
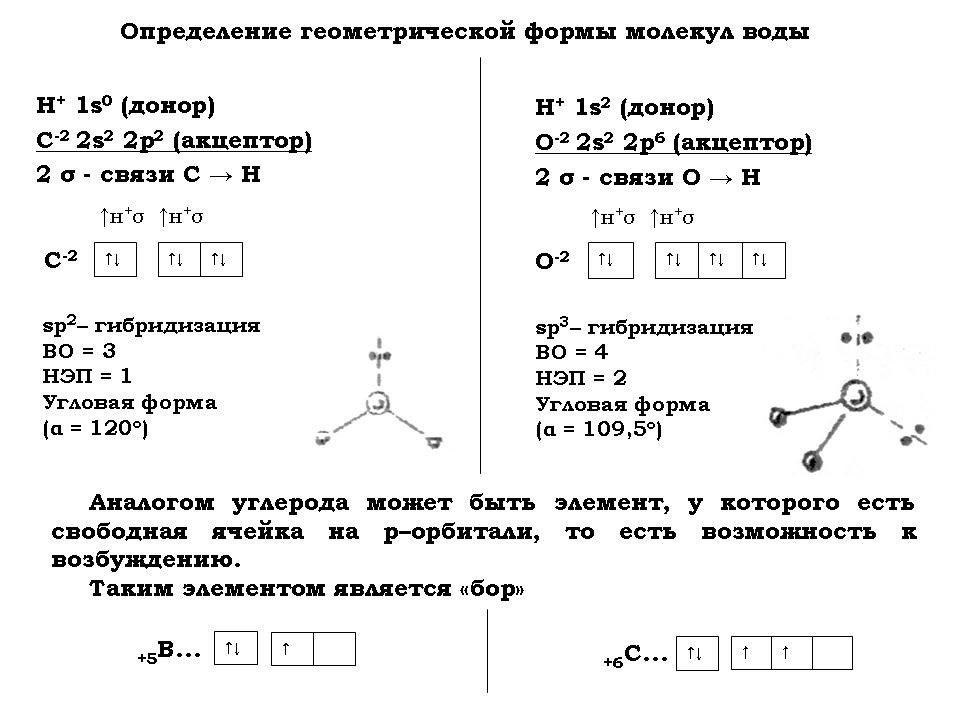
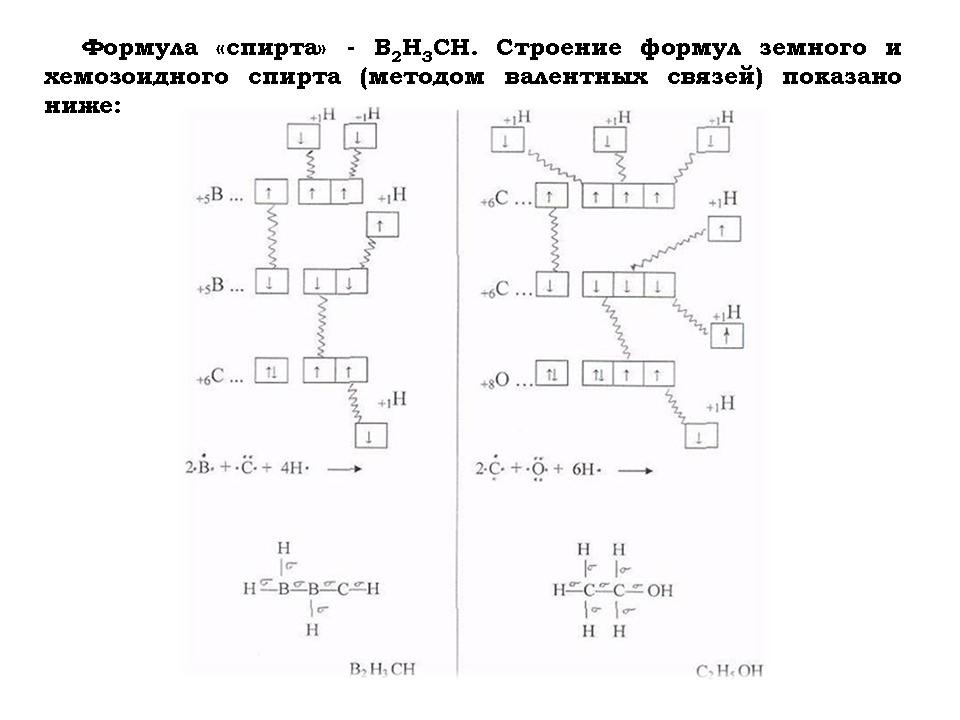
- Для того чтобы определить, чем умываются и напиваются хемозоиды, составить химические формулы их “воды” и “спирта”.
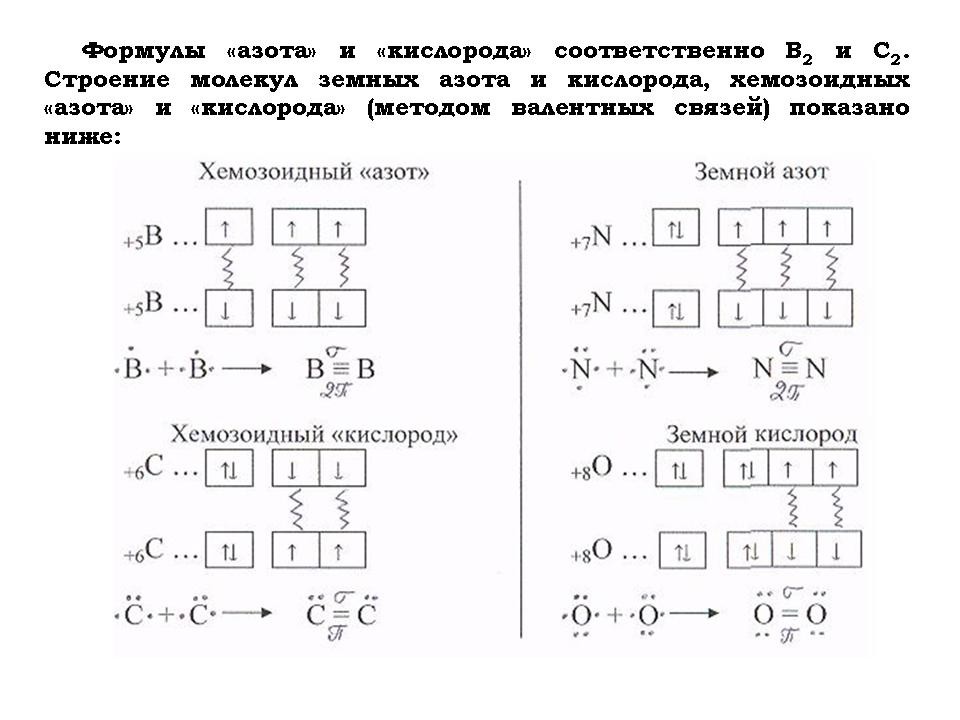
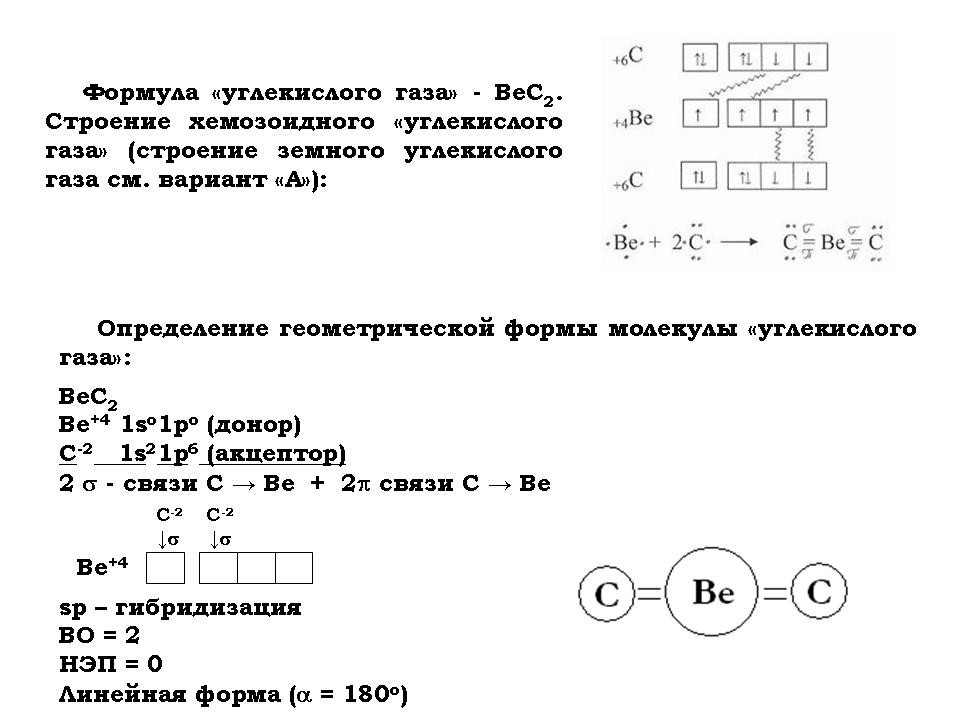
- Для того чтобы определить, чем дышат хемозоиды, составить химические формулы основных компонентов их “воздуха”, таких как “азот”, “кислород” и “углекислый газ”.
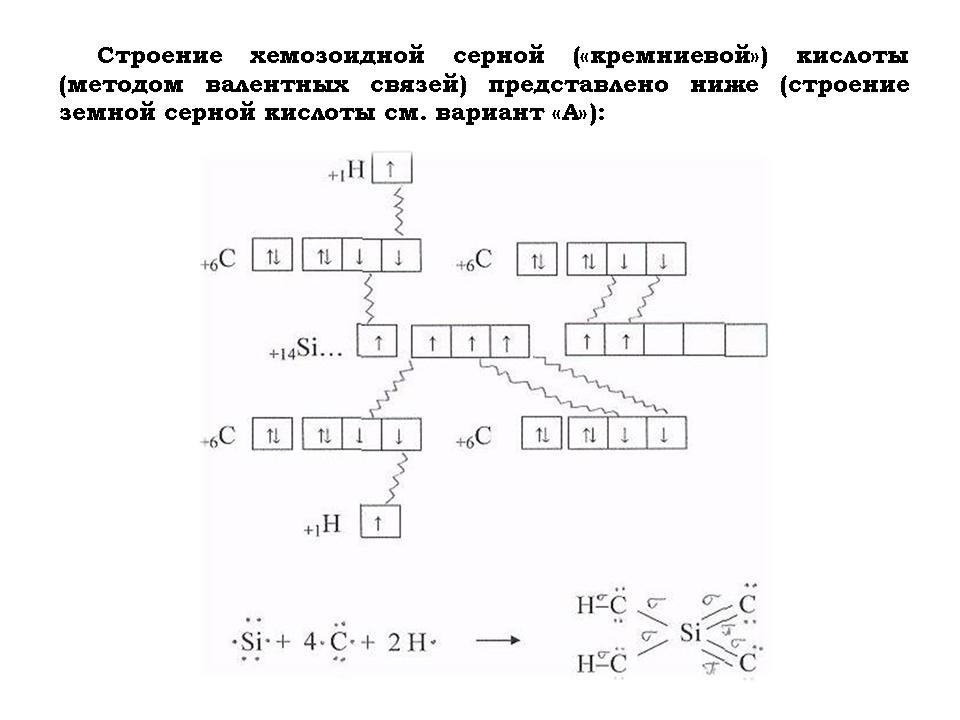
- Написать уравнение химической реакции их “серной кислоты” с “гидроксидом кальция”.
- Написать уравнение химической реакции их “соляной кислоты” с “гидроксидом натрия”.
5. Работа в группах (первая группа предлагает решение варианта “А”, а вторая – “В”).
6. Проверка результатов самостоятельной работы в группах над творческим заданием (слайды №№ 6-17; см. Приложение 2 и Приложение 3).
7. Домашнее задание (слайд №18; см. Приложение 4 и Приложение 5).
Использованная литература
- Габриелян О.С. Настольная книга учителя. Химия. 11 класс: В 2ч. Ч.I / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская. – М., 2003. – С.24-171.
- Габриелян О.С . Химия. 11 класс: Учеб. для общеобразоват. учреждений /О.С. Габриелян, Г.Г. Лысова. – М., 2002. – С.3-64.
- Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубинной. – Л.: Химия, 1988.
- Зайцев О.С . Неорганическая химия: Теорет. основы: Углубл. курс: Учеб. для общеобразоват. учреждений с углубл. изуч. предмета. – М., 1997. – С.12-79.
- Зайцев О.С . Химия. Современный краткий курс. Учебное пособие. – М., 1997. – С.24-50.
- Крапетьянц М.Х., Дракин С.И . Строение вещества. Учебное пособие для вузов. – М., 1978. – С.55-100.
- Клечковский В.М. Распределение атомных электронов и правило последовательного заполнения (n + l) групп. – М., 1968.
- Лидин Р.А., Аликберова Л.Ю. Химия: Справочник для старшеклассников и поступающих в вузы. – М., 2002. – С.34-35.
- Метельский А.В. Химия в экзаменационных вопросах и ответах: Спр. для учителей, репетиторов и абитуриентов. – Мн., 1997. – С.94-95.
- Некрасов Б.В . Основы общей химии. Т.1. – М., 1973. – С.212-237.
- Папулов Ю.Г., Левин В.П., Виноградова М.Г. Строение вещества в естественнонаучной картине мире: Молекулярные аспекты: Учебное пособие. – 2-е изд., испр. и доп. – Тверь: Твер. гос. ун-т, 2005.
- Папулов Ю.Г . Строение молекул: Учебное пособие. – Калинин, 1974. – С.51-81.
- Полинг Л., Полинг П . Химия. – М., 1978. – С.99-125.
- Ремсден Э.Н . Начала современной химии: Справ. изд.: Пер. с англ. / Под ред. В.М. Барановского, А.А. Белюстина, А.И. Ефимова, А.А. Потехина. – Л., 1989. – С.35-124.
- Семенькова Н.И . Изучение периодического закона Д.И. Менделеева в школе: Кн. для учителя: из опыта работы. – М., 1992. – С.3-55.
- Степин Б.Д., Цветков А.А . Неорганическая химия: Учеб. для хим. и химико-технол. спец. вузов. – М., 1994. – С.30-58.
- Строение молекул: Учеб. пособие / Ю.Г. Папулов. – Тверь, 1994.
- Фримантл М. Химия в действии. В 2-х ч. Ч.2: Пер. с англ. – М., 1998. С. 5-30.
- http://hemi.wallst.ru/ – Химия. Образовательный сайт для школьников и студентов.
- http://schoolchemistry.by.ru/ – Учебно-справочный материал для школьников.
- Сайфуллин Р.С., Сайфуллин А.Р. Современную периодическую систему элементов – в школьное образование//Химия: методика преподавания. 2004. №2. С. 4-11.