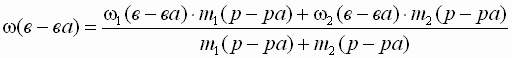Интеграция знаний по различным учебным дисциплинам является одним из эффективных форм развития научного познания. Современная химия не может обойтись без математических знаний, поэтому необходимо показать на практике школьникам связь этих наук. К тому же задачи одного и того же типа встречаются в заданиях ЕГЭ как по химии, так и по математике.
Урок проводят два учителя: учитель математики и учитель химии, рассчитан урок на 2 часа.
Цели урока:
Общая дидактическая цель:
Показать применение различных способов для решения задач с использованием понятия “доля”.
Обучающие цели:
Актуализировать такие понятия как “доля”, “процент”. Научить решать задачи, применяя “правило смешения” и “правило креста”.
Развивающие цели:
Способствовать формированию умения применять приемы и понятия одной области знания – математики – на примерах из другой области – химии, способствовать формированию умения применять приемы логического мышления, способствовать развитию грамотной устной и письменной химической и математической речи.
Воспитывающие цели:
Создать условия для развития коммуникативной культуры, диалогической речи учащихся.
Оборудование: мультимедиа проектор.
Урок проводится с использованием электронной презентации, в которой отображены основные этапы урока. Каждому учащемуся приготовлена памятка (приложение 1), с которой он работает в течение урока. В памятке отображены основные этапы урока.
Оформление доски: Формула для массовой доли.
Ход урока
Этапы урока / Слайды |
Деятельность учителей |
Деятельность учащихся |
| I. Организационный момент. | ||
| Слайд 1 | Учитель математики, учитель химии:
Приветствие. Начало урока. Организация внимания
учащихся. Обратить внимание учащихся на памятку, где в течение урока они будут записывать наиболее важные моменты. |
Приготовление к работе. Включение в деловой ритм. |
II. Актуализация знаний учащихся. |
||
II. 1. Подготовка к активному усвоению материала. |
||
| Слайд 2 | Учитель химии: Обратите
внимание на задачи, приведенные на слайде. Это
задачи из вариантов ЕГЭ различных лет. По какому
предмету? По химии и математике. Несложно отметить, что задачи одинаковые, по одной теме. Решению именно таких задач и будет посвяще6н наш сегодняшний урок. |
Отвечают на вопрос, высказывая предположения, что задачи относятся и к единому экзамену как по математике так и по химии. |
| Слайд 3 | ||
| II. 2.Актуализация знаний учащихся по математике. | ||
| Слайд 4 | Учитель математики: Начнем урок с понятия “доля”. Строгое определение этого понятия: доля – обыкновенная дробь, числитель которой равен единице. Но в прикладных науках, физике, химии, биологии, медицине по данным понятием часто подразумевают дробь, например 0,4. Для обозначения доли используют греческую букву “омега”. | Записываю в памятку определение доли. |
| Слайд 5 | Учитель математики: С понятием
“доля” тесно связано и другое понятие –
процент. Процент – одна сотая часть чего-либо. Соответственно, первое задание: перевести доли в проценты и наоборот. |
Выполняют устно задание. |
| II. 3. Актуализация знаний учащихся по химии. | ||
| Слайд 6 | Учитель химии: Данные понятия
(доля и процент) чаще всего используются описания
составов растворов и сплавов. Рассмотрим
подробнее растворы и сплавы. Начнем с растворов. Растворы – однородные смеси двух или большего числа веществ (компонентов). |
Слушают рассказ учителя. |
| Слайд 7 | Учитель химии: Обычно мы имеет
дело с водными растворами, где растворителем, то
есть веществом, которого в растворе больше,
является вода. Вода – самое распространенное сложное вещество на Земле. Вода – хороший растворитель для многих веществ. |
Слушают рассказ учителя. |
| Слайд 8 | ||
| Слайд 9 | Учитель химии: Теперь перейдем к
сплавам. Сплавы – это системы из двух или нескольких металлов (или металлов и неметаллов), обладающие по сравнению с чистыми металлами как общими металлическими, так и новыми ценными свойствами. Количество сплавов намного больше, чем чистых металлов. Применение их разнообразно. Далее я расскажу о наиболее известных сплавах. Задание – во время рассказа заполнить таблицу в памятке: записать название сплава и области его применения. |
Слушают рассказ учителя и выполняют задание по заполнению таблицы. |
| Слайд 10 Слайд 11 |
_Учитель химии: Рассмотрим наиболее распространенные сплавы. Самым широко используемым и известным сплавом является сталь. Из нее изготовляю различные промышленные детали и предметы обихода. | Учитель химии: Следующий известный сплав – бронза. |
| Слайд 12 | Бронза – это сплав таких металлов как медь и олово. | |
| Слайд 13 | ||
| Слайд 14 | Учитель химии: Дюралюминий – сплав алюминия с небольшими добавками меди, магния, марганца и кремния. Это очень легкий и прочный сплав, который применяется в самолетостроении. | |
| Слайд 15 | Учитель химии: Для изготовления ювелирных изделий тоже применяются сплавы, например сплавы золота с другими металлами. | |
| Слайд 16 | Учитель химии: Некоторые сплавы, например томпак – ”поддельное золото” – сплав меди и цинка, часто используются для имитации драгоценный металлов. | |
| Слайд 17 | Учитель химии: Так же часто используются латунь, сплав Вуда, монель-металл. | |
| Слайд 18 | ||
| Слайд 19 | ||
| Слайд 20 | Учитель химии: Как видно из
фотографий, представленных на слайдах – сплав
отличается от исходных металлов. Причем это
отличие не только по цвету, что вы можете
наблюдать, но и по другим физическим свойствам.
Так сплавы тверже, чем исходные металлы. Мы рассмотрели сплавы, и у вас заполнена таблица, характеризующая области их применения. |
Один из учащихся зачитывает таблицу. |
| III. Изучение нового материала. | ||
| Слайд 21 | Учитель химии: Теперь, рассмотрев, различные виды сплавов и растворы переходим к решению задач, где используются эти понятия. | |
| Слайд 22 | Учитель математики: Начнем с
допущений, которые используются при решении
таких задач:
объемы растворов и массы сплавов не могут быть отрицательными. |
|
| Слайд 23 | Учитель химии: Наиболее часто
для описания состава раствора или сплава
используется такая величина как массовая доля.
Массовая доля – это отношение массы вещества к
массе раствора или сплава. Данное определение
можно записать в виде следующей формулы. С помощью данной формулы можно решать простейшие задачи на приготовление растворов или сплавов. |
Записывают формулу в памятку. |
| Слайд 24 | Учитель математики: Данная
формула применима только для простейшего случая
одного раствора или сплава. Мы будем решать задачи на смешивание двух растворов, поэтому нам необходимо ввести дополнительные обозначения:
m1(в-ва), m2(в-ва), m(в-ва) – массы растворенных веществ в соответствующих растворах; m1(р-ра), m2(р-ра), m(р-ра) – массы соответствующих растворов. |
Знакомятся с обозначениями. |
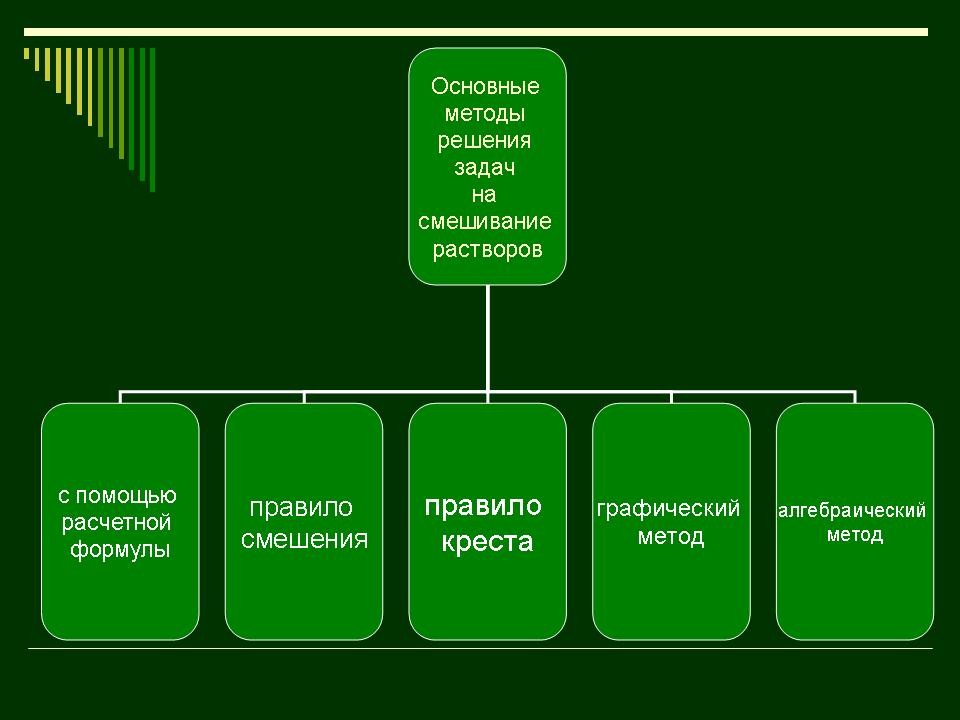
| Слайд 25 | Учитель математики: Существует
пять способов решения задач на смешивание
растворов и сплавов. Это:
Рассмотрим каждый из этих способов. |
В течение рассказа учителя заполняют схему. |
| Слайд 26 | Учитель математики: Первый
способ: С помощью расчетной формул. Для решения задач с помощью этого способа нам нужно вспомнить формулу доли и наши обозначения. Тогда, Масса полученного при смешивании раствора равна: т(р-ра) = т1(р-ра) + т2(р-ра) массы растворенных веществ в первом и втором растворах: т1(в-ва) = масса растворенного вещества в полученном растворе вычисляется как сумма масс веществ в исходных раствopax: т(в-ва) = m1(в-ва) + т2(в-ва) =
Таким образом, массовая доля растворенного вещества в полученном растворе равна:
|
Заполняют памятку. |
| Слайд 27 | ||
| Слайд 28 | Учитель математики: Второй
способ: “Правило смешения” Формулу для правила смешения можно получить из предыдущего результата. Таким образом, отношение массы первого раствора к массе второго равно отношению разности массовых долей смеси и второго раствора к разности массовых долей первого раствора и смеси. Эта формула удобна тем, что на практике, как правило, массы веществ не отвешиваются, а берутся в определенном отношении. |
Заполняют памятку. |
| Слайд 29 | Учитель химии: Все выше
перечисленные способы имеют свои преимущества,
но они достаточно длинные. Есть способ решения
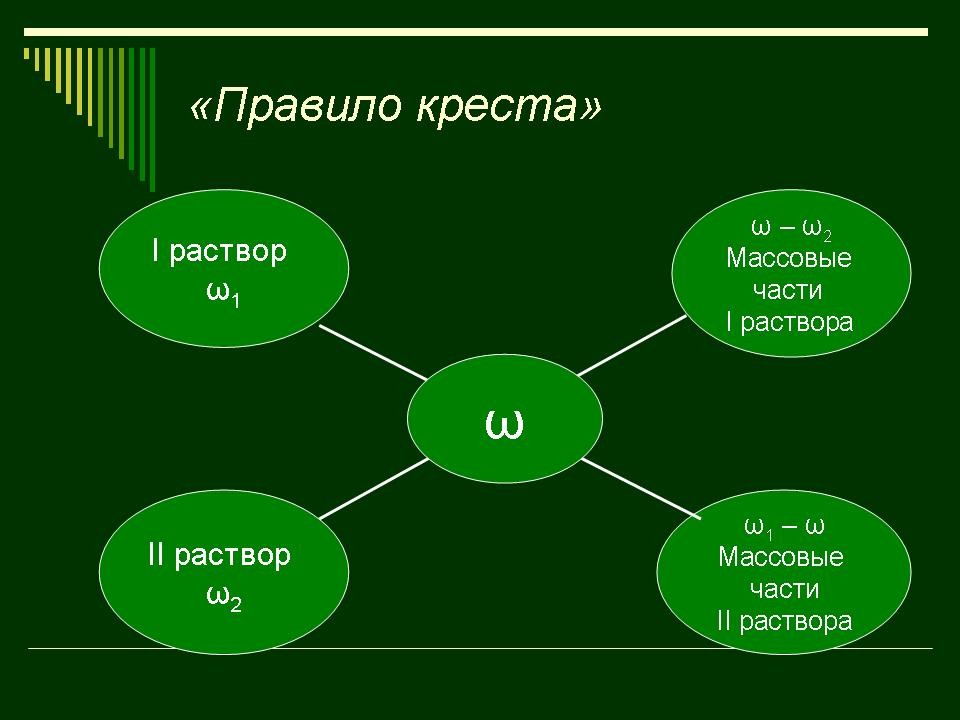
таких задач более короткий. Это так называемое
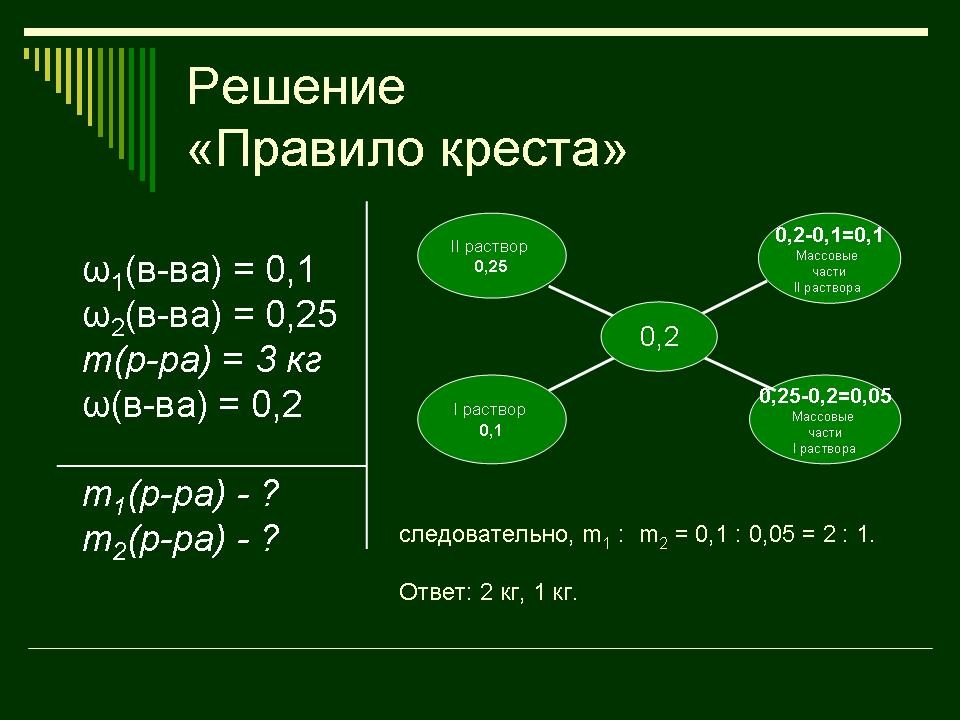
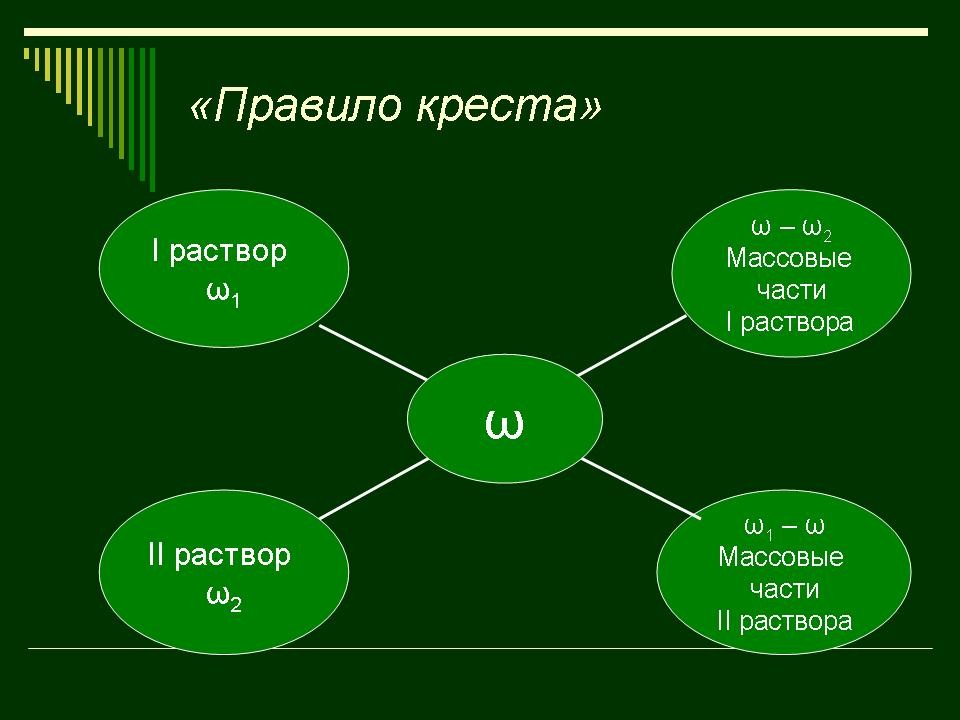
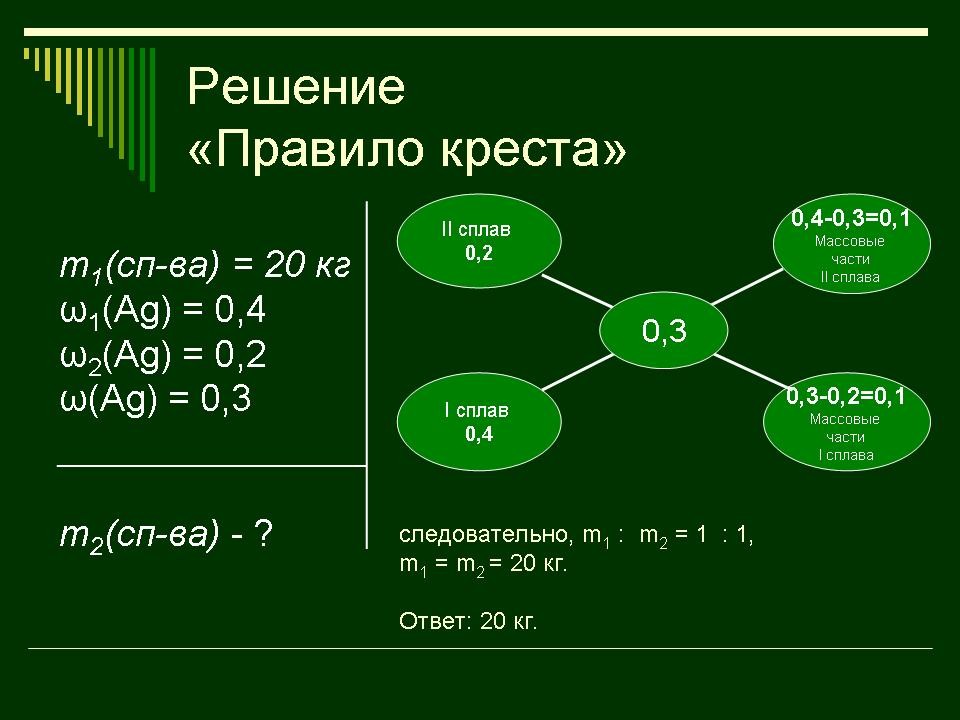
правило креста. “Правилом креста” называют диагональную схему правила смешения для случаев с двумя растворами. Слева на концах отрезков записывают исходные массовые доли растворов (обычно слева вверху – большая), на пересечении отрезков – заданная, а справа на их концах записываются разности между исходными и заданной массовыми долями. Получаемые массовые части показывают, в каком отношении надо слить исходные растворы. |
Заполняют схему в памятке. |
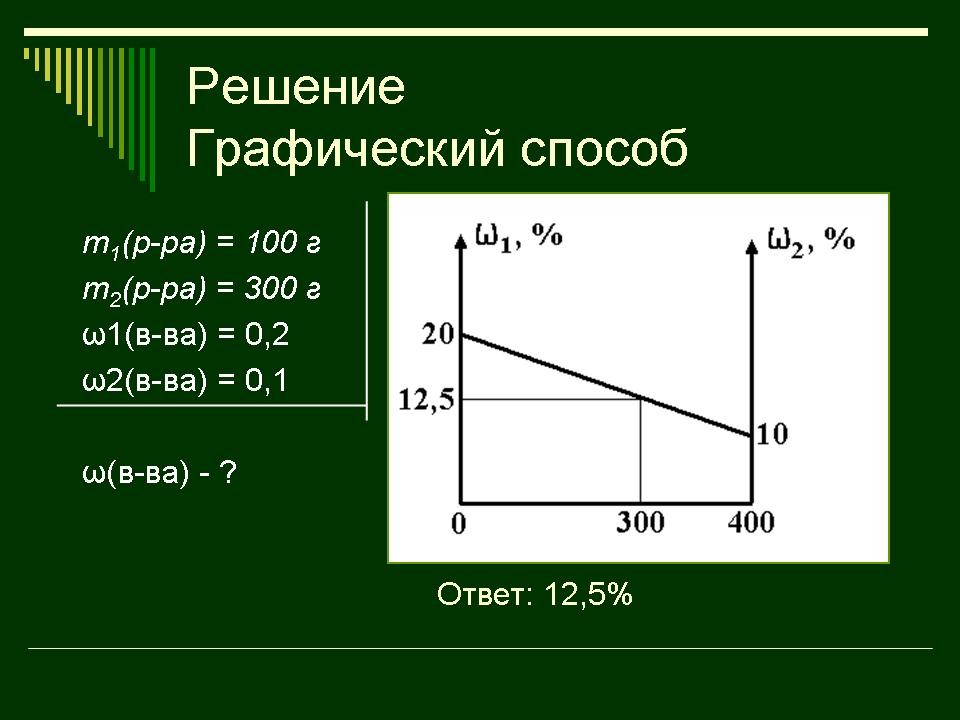
| Слайд 30 | Учитель химии: Следующий
наглядный способ – графический способ Отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат oткладывают точки, соответствующие массовым долям pacторенного вещества в исходных pacтopax. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли рacтвoренного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости полученная функциональная прямая позволяет решать задачи по определению массы смешанных растворов и обратные, по массе смешанных растворов находить массовую долю полученной смеси. Данный способ является наглядным и дает приближенное решение. При использовании миллиметровой бумаги можно получить достаточно точный ответ. |
Знакомятся с данным способом решения задач. |
| Слайд 31 | Учитель математики: Последний
рассматриваемый способ: Алгебраический. Задачи на смешивание растворов решают с помощью составления уравнения или системы уравнений. |
Знакомятся с данным способом решения задач. |
| Слайд 32 | Учитель химии: Каждый из рассмотренных способов имеет свои преимущества и недостатки. При решении конкретной задачи необходимо оценивать возможность использования того или иного способа. | |
| IV. Закрепление знаний учебного материала. | ||
| IV.1. Решение задач на приготовление растворов или сплавов. | ||
| Слайд 33 | Учитель химии: Познакомившись
со способами решения, перейдем к собственно
решению задач. Начнем с простых задач на
приготовление растворов и сплавов. Первую задачу
решаем вместе. Учитель химии решает первую задачу на доске, показывая оформление задачи. Затем вызывает учащихся к доске. Проверяет решение задач. В ходе решения обращает внимание на понятие плотности как отношения массы к объему. |
Решают задачи в тетради и у доски. Сравнивают свое решение с решением, представленным на доске. |
| Слайд 34 | ||
| IV.2. Решение задач на сложные проценты. | ||
| Слайд 35 | Учитель математики: Теперь
переходим к более сложным задачам. Учитель математики разбирает решение первой задачи алгебраическим методом, учитель химии – по расчетной формуле и графически. |
Записывают в тетрадь три способа решения задачи. |
| Слайд 36 | ||
| Слайд 37 | ||
| Слайд 38 | ||
| Слайд 39 | Учитель химии: Переходим к
решению следующей задачи. Учитель математики разбирает решение задачи алгебраическим методом, учитель химии – по расчетной формуле, по “правилу креста” и графически |
Записывают в тетрадь три способа решения задачи. |
| Слайд 40 | ||
| Слайд 41 | ||
| Слайд 42 | ||
| Слайд 43 | ||
| Слайд 44 | Учитель химии, учитель математики:
учитель математики разбирает решение первой
задачи из этого блока на доске алгебраическим
методом, учитель математики – с помощью
“правила креста”. Дают задание учащимся решить задачи № 2 и 3 различными способами. На решения каждой задачи к доске вызывает двух учащихся для решения задач различными способами. Учителя помогают учащимся при возникновении затруднений, проверяют решение. |
Решают задачи различными способами. |
| Слайд 45 | ||
| IV. 3.Самостоятельная работа. | ||
| Слайд 46 | Учителя предлагают учащимся самостоятельно решить задачу №4 различными способами. (10 мин.) | Учащиеся решают задачу в тетради. |
| Слайд 47 | Проверяют решение задачи, используя готовой на слайдах или вызывая учащихся к доске. | |
| Слайд 48 | ||
| Слайд 49 | ||
| Слайд 50 | В конце урока учителя делают вывод, о том, что существуют несколько способов решения задач с использованием понятия “доля”, в различных ситуациях можно применять различные из них. | |
| V. Информирование учащихся о домашнем задании. | ||
| Домашнее задание: решить задачи № 5 и 6. | Записывают домашнее задание. | |
| VI. Завершение урока (3 мин.) | ||
| Слайд 51 | Благодарят учащихся за работу. | |
Срезовая работа проводилась на следующий день после проведения бинарного урока.
Цель срезовой работы: проверить усвоение способов решения задач с использованием понятия “доля”.
Работа (приложение 2) состояла из трех задач, первая из которых – простейшая задача на приготовления раствора (вариант 2) или сплава (вариант 1). Две следующие задачи – задачи на сложные проценты.
Можно отметить, что все учащиеся справились с первой задачей, вторая задача вызвала затруднения на этапе вычисления массовых частей растворов, хотя схема “правила креста” была составлена верно (вариант 1). Некоторые учащиеся указали ответ в задаче не в килограммах, а в граммах, хотя, по сути, задача была решена верно (вариант 2). С третьей задачей справилось большинство учащихся, некоторые учащееся сделали ошибки при оформлении или при переводе из долей в проценты.
Проведенная срезовая работа позволяет сделать вывод, что большинство учащихся усвоило способы решения задач.
Литература:
Элективный курс. Текстовые задачи: сложности и пути их решения. Алгебра. 9 класс/ Составитель Г. И. Григорьева. – Волгоград: “Корифей”.