Тип урока: усвоение новых знаний.
Цели урока:
- сформировать понятия “степень окисления”, “постоянная, переменная степень окисления” “бинарные соединения”;
- познакомиться с правилами определения степеней окисления, с номенклатурой и принципом составления названий бинарных соединений, с алгоритмом составления формул веществ по названиям.
1. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентные полярные) состоят из ионов.
2. С.О. положительная “+” и отрицательная “-” ставится над знаками элементов перед цифрами, в том числе и единицей.
ПРАВИЛА:
- Степень окисления свободных атомов и простых
веществ равна 0: (
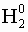 ; Mg0)
; Mg0) - Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH-1, H+1Cl).
- Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
- Степень окисления кислорода в соединениях равна -2 (NO-2, Al2O-23), а в пероксидах -1 (H2O-12, O+1F2)
- Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
- Суммарная степень окисления всех атомов в молекуле равна 0.
- Высшая степень окисления элемента равна (+№ группы).
- Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
- Элементы в высшей степени окисления могут только принимать электроны
- Элементы в низшей степени окисления могут только отдавать электроны
- Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны.
ЗАДАНИЕ:
- Определить степени окисления элементов в веществах: Na2O; O2; H2SO4; N2; S; H2O; Al; Cu; HNO3; F2; Ca.
- Подчеркнуть бинарные соединения.
СТЕПЕНЬ ОКИСЛЕНИЯ:
постоянная |
переменная (указывается в скобках римской цифрой) |
элементы I-А, II-А, III-А– группы |
все остальные |
Бинарные соединения (“би” – два) – состоят из двух химических элементов.
В соединениях на первом месте пишется элемент (или частица) с положительной степенью окисления, а на втором — с отрицательной с.о.
Алгоритм определения степеней окисления по формуле:
- Определение степеней окисления начинают с того элемента, у которого С.О. (Р2О-25); постоянная или известна в соответствии с правилами (см. выше);
- Умножить эту С.О. на индекс атома (или группы) (– 2 * 5 = – 10);
- Полученное число разделить на индекс второго элемента (или группы) (– 10 / 2 = – 5);
- Записать полученную С.О. с противоположным знаком (Р+52О-25).
ЗАДАНИЕ:
Расставить степени окисления в соединениях: Na; K2O; Fe; CaCO3; AlCl3; Li3N; BaSO4; Zn; H2CO3; O3; OF2; CuSO4; NaOH; O2; SO3; KH; KOH; BaH2; H2O; NH3.
НАЗВАНИЯ БИНАРНЫХ СОЕДИНЕНИЙ:
| латинское название элемента с отрицательной степенью окисления (“-”) + суффикс -ид | русское название элемента с положительной степенью окисления (“+”) в родительном падеже | (римская цифра переменной степени окисления) |
Пример: Al+32O-23 – оксид алюминия; Cu+2O-2 – оксид меди (II)
Cl-1 – хлорид; O-2 – оксид; Н-1 – гидрид; S-2 – сульфид; C-4 – карбид; N-3 – нитрид; P-3 — фосфид; Si-4 — силицид.
Алгоритм составления формул по названиям:
- Записать знаки элементов (частиц) в порядке: на первом месте – положительно заряженную, на втором – отрицательно заряженную ( Al O );
- Расставить степени окисления ( Al+3 O-2);
- Найти наименьшее общее кратное (НОК) между значениями степеней окисления, записать его между ними в “окошечко”;
- Разделить НОК на значение степеней окисления, полученные результаты записать как индексы (6/3=2; 6/3=3 Al2O3).
ЗАДАНИЕ:
Составить формулы веществ по названиям:
- хлорид кальция
- оксид железа (III)
- оксид азота (V)
- хлорид серы (IV)
- сульфид хрома (VI)
- гидрид магния
- карбид алюминия