Цели урока:
- На основании знаний о строении атома начать формирование понятий «химическая связь», «ковалентная связь», «электроотрицательность», «ковалентная полярная и неполярная связь».
- Научить школьников записывать схемы образования ковалентной связи для двухатомных молекул.
- Сформировать понятие о кратности ковалентной связи.
- Разъяснить смысл электронных и структурных формул.
Тип урока: Формирование новых знаний
Вид урока: Мультимедиа урок.
Оборудование: компьютер, проектор, мультимедийные ресурсы, периодическая система химических элементов Д.И.Менделеева.
ХОД УРОКА
I. Организационный момент
II.Актуализация знаний
Прежде чем рассматривать механизм ковалентной
связи, учитель предлагает повторить с учащимися
строение атома и распределение электронов по
энергетическим уровням; объяснить на основании
строения атома причину химической инертности
атомов благородных газов; рассмотреть, что такое
завершенный электронный слой. (Презентация
1)
Несколько учащихся на макете составляют
электронные формулы (Презентация 4)
III. Изучение нового материала
Основными объектами окружающего нас мира
являются атомы и молекулы. Наверняка многие из
вас знают, что из атомов и молекул состоят все
вещи в мире. Тогда как вы объясните, чем они
отличаются? Если бы все атомы были
одинаковыми, в мире существовал бы лишь один вид
материи.
Вам известно, что в настоящее время, существует
более ста разновидностей атомов, которые могут
соединяться между собой. Если соединяются
несколько атомов одного вида, они образуют
простые вещества. Существуют и такие вещества,
молекулы которых состоят из двух-трех и более
атомов разного вида – их называют сложными.
Каждое вещество имеет свое название и обладает
уникальными свойствами. Каким же образом атомы
соединяются между собой?
Далее обсуждаем, все ли атомы химических
элементов соединяются. Нет ли в природе
одиночных атомов? Оказывается, есть – это атомы
благородных газов.
Электроны в атоме располагаются на
энергетических уровнях. Электроны наружного
слоя называют валентными. Полностью заполненным
энергетическим уровнем обладают элементы VIII
А группы – благородные (инертные) газы.
Сравниваем электронное строение атомов
благородных газов, выясняем особенность
завершенных и устойчивых внешних энергетических
уровней:
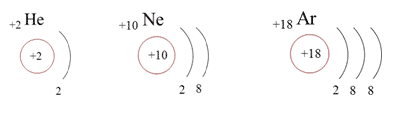
Чем объяснить устойчивость внешнего восьмиэлектронного уровня? Причина этого заключается в том, что все электроны на внешних энергетических уровнях элементов спарены, то есть уже в атомах связаны попарно.
Поскольку электронная конфигурация
благородного газа очень устойчива, то её
стремятся достичь и атомы других элементов. Все
атомы, объединяясь в молекулы, сделать это могут
либо, отдав электроны, либо приняв электроны,
либо обобществив свои электроны с электронами
других атомов.
Число электронов, необходимых атомам разных
химических элементов до завершения внешнего
электронного слоя, различно.
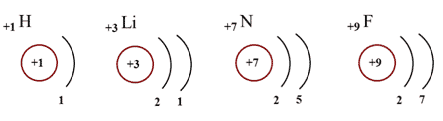
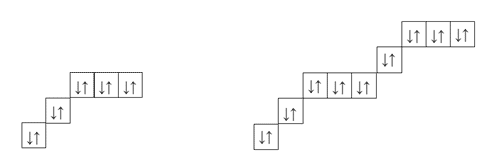
Внешние электронные слои атомов других химических элементов могут содержать как спаренные, так и не спаренные электроны.
Предлагаем учащимся подсчитать, сколько электронов не хватает атомам каждого из химических элементов второго периода для завершения внешнего электронного слоя.
Вывод: если в атоме нет непарных
электронов и нет возможности для их
распаривания, как у инертных газов, они не
образуют химической связи и соединений не
образуют, потому и инертны. В образовании
химической связи участвуют в основном непарные
электроны наружного слоя атома. Сущность
образования химической связи состоит в
спаривании непарных электронов.
Ребята, мы ответили на один вопрос, поставленный
в задачу нынешнего урока.
– Что заставляет атомы соединяться друг с другом
в молекулы?
А вот как происходит это спаривание, нам
предстоит разобраться.
Интересно, например, как осуществляется связь
между атомами элементов-неметаллов, которые
имеют сходную тенденцию к присоединению
электронов? Рассмотрим вначале, как образуется
связь между атомами одного и того же химического
элемента, например в веществах, имеющих
двухатомные молекулы.
Два одинаковых атома элемента-неметалла могут
объединяться в молекулу только одним способом:
обобществив свои внешние электроны, то есть,
сделав их общими для обоих атомов.
Когда атомы обобществляют свои электроны,
образуется ковалентная связь.
Ковалентная связь – это химическая
связь, возникающая в результате образования
общей электронной пары между взаимодействующими
атомами.
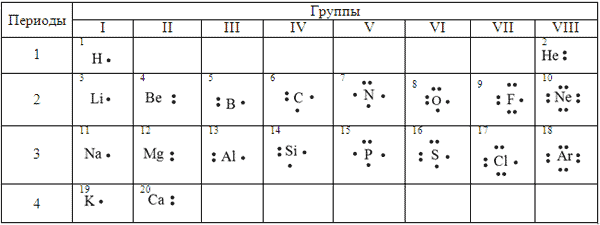
Для наглядности изображения того как образуется
ковалентная связь используются электронные
формулы. В ней каждый атом обозначается
буквенными символами соответствующего элемента,
а вокруг этого символа точками обозначают все
валентные электроны, в том числе и не участвующие
в образовании связи. Одна точка обозначает один
электрон.
Например: электронная формула водорода ![]()
электронная формула хлора ![]()
электронная формула кислорода ![]()
электронная формула азота ![]()
Для образования связи каждый атом предоставляет в общее пользование по одному электрону. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. При этом образующаяся пара электронов принадлежит одновременно двум атомам.
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
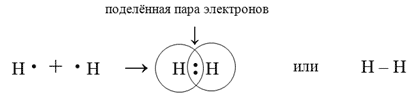
Ядро атома водорода окружено сферическим электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния начинают действовать силы притяжения между ядром одного атома и электроном другого атома, а так же силы отталкивания между ядрами и между электронами
Ковалентная связь бывает двух видов – ковалентная неполярная и ковалентная полярная. Связано такое деление с тем, где именно между ядрами будут располагаться общие электронные пары – ровно посередине или будут смещены в сторону одного из ядер.
Расположение общих электронных пар между ядрами связывающихся атомов зависит от электроотрицательности атома.
Электроотрицательность – это способность
атомов химического элемента оттягивать к себе
общие электронные пары, участвующие в
образовании химической связи.
У элементов рассчитали значение
электроотрицательности и расположили их по
возрастанию этого значения в ряд
электроотрицательности (приводится не
полностью):
| Элемент | K |
Na |
Сa |
Mg |
Al |
Si |
B |
H |
C |
S |
I |
Br |
Cl |
N |
O |
F |
χ |
0.9 |
0.93 |
1.0 |
1.2 |
1.47 |
1.74 |
2.01 |
2.1 |
2.5 |
2.58 |
2.66 |
2.74 |
2.83 |
3.07 |
3.5 |
4.0 |
Используя периодическую систему химических элементов Д.И. Менделеева, объясняем, что в периодах, слева направо, электроотрицательность увеличивается, в главных подгруппах сверху вниз – уменьшается. Что касается ряда то, правее стоящий в этом ряду элемент обладает большей электроотрицательностью и лучше оттягивает в свою сторону общие электронные пары. Фтор самый электроотрицательный элемент.
Если молекула состоит из атомов одного вида, электроотрицательность которых равна, то общие электронные пары будут находиться посередине между ядрами двух связывающихся атомов, поскольку ядра притягивают общие электронные пары в равной степени. В этом случае между атомами образуется ковалентная неполярная связь. Ковалентная неполярная связь образуется в таких молекулах как Н2, F2, N2 и т.д.
Пример образования ковалентной неполярной связи вмолекуле фтора.
Рассмотрим образование ковалентной связи в молекуле фтора F2.
Электронная формула внешнего слоя атома фтора: 1s22s22p5, электронно-графическая формула:
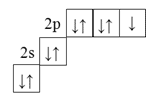
Один из р-электронов в атоме фтора является неспаренным.
При образовании молекулы неспаренные электроны двух атомов фтора образуют одну общую электронную пару; в результате каждый атом фтора приобретает электронную структуру 2s22p6, т.е. на внешнем энергетическом уровне помещается по восемь электронов.
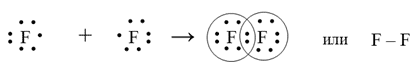
Демонстрация схемы образования ковалентной неполярной химической связи в молекуле фтора. (Презентация 3, слайд 2)
Связь между атомами может быть образована и несколькими электронными парами. Существуют молекулы, в которых между двумя атомами возникают две или три общие электронные пары. Такие ковалентные связи называются двойными и тройными, а общее их название – кратные связи. При увеличении числа общих электронных пар прочность ее увеличивается.
Например, в молекулах водорода H2 и фтора F2 связь между атомами водорода и фтора соответственно – одинарная (однократная), в молекуле кислорода O2 – двойная, а в молекуле азота N2 – тройная. (Презентация 3, слайды 3, 4)
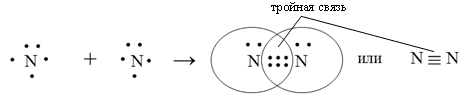
Подводим учащихся к выводу о том, что кратность связи в молекуле определяется (в основном) числом непарных электронов.
При соединении атомов одного элемента никакого
смещения электронов не происходит, т.к. их
электроотрицательность одинакова.
Если ковалентная связь образуется между
атомами с различной ЭО, то общая электронная пара
смещается в сторону атома с большей ЭО.
Схематично образование ковалентной полярной связи в молекуле НF можно изобразить так:
![]()
Молекула фтороводорода образована элементами, отличающимися по своей ЭО.
Δ Э.О. = 3,98 – 2,20 = 1,78
Общая электронная пара оказывается смещенной в сторону фтора, в результате на атоме фтора возникает частичный отрицательный заряд δ– (дельта минус), а на атоме водорода – частичный положительный δ+ (дельта плюс) Нδ+Fδ–. Таким образом, молекула становится полярной. Чем больше различается электроотрицательность взаимодействующих атомов, тем больше смещена общая электронная пара к наиболее электроотрицательному атому, тем полярнее химическая связь между атомами. (Презентация 3, слайд 5)
Направление смещения электронов обозначается также стрелкой: C ––> Cl, C ––> О, C ––> N, О <–– Н, C <–– Mg
Ковалентная химическая связь между атомами разных элементов, при которой общая электронная пара (пары) смещена в сторону более ЭО элемента (разность ЭО < 1,9), называется ковалентной полярной.
Молекулы хлороводорода, воды, аммиака также являются полярными. Их еще называют диполями (имеющими два полюса).

Общую пару электронов иногда обозначают черточкой, которая символизирует химическую связь. Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
H:Cl H–Cl
Электронные и структурные формулы показывают последовательность соединения атомов в молекуле. Например, в молекуле аммиака атомы водорода соединяются с атомами азота, но между собой не соединяются.
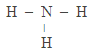
Под числом химических связей подразумевают число общих пар электронов. В структурной формуле соединения, число черточек, отходящих от данного атома, равно его валентности.
IV. Закрепление
Составление схемы образования ковалентной
полярной связи в молекуле Н2O. (Презентация
3, слайд 6)
Выполнение тренировочного теста по теме. (Презентация
2)
V. Домашнее задание
§ 40, § 41, с 141 – 144. Составить схемы образования ковалентной связи в молекулах Сl2 и HCl.