За один урок очень сложно рассказать об элементе, строении его атома, свойствах веществ, в состав которых он входит, получении и применении этих веществ. Предлагаем разработку урока, посвященного алюминию. Этот материал можно использовать и в 11 классе при повторении темы «Металлы».
Статья сопровождается авторской презентацией.
Оборудование и реактивы: Диаграмма «Распространение элементов в земной коре», «Периодическая система химических элементов», инструктивные карты (для каждого ученика), пробирки, штатив пробирочный, спиртовка, спички, пробиркодержатель, алюминий, образцы соединений алюминий, коллекция сплавов на основе алюминия, серная, соляная кислоты (разбавленные растворы), горячая вода в стакане.
Задачи:
- Образовательные: сформировать знания о химическом элементе алюминии, физических и характерных химических свойствах простого вещества алюминия, сформировать понятие о составе и свойствах оксидов и гидроскидов алюминия.
- Развивающие: продолжать формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ, способствовать развитию исследовательских навыков, развивать представление о познаваемости и единстве окружающего мира путем изучения информации об алюминии, его соединениях, нахождении в природе, продолжать формировать умения работать в темпе, экономя время урока.
- Воспитательные: воспитывать чувство гордости за свою Родину как самую богатую природными ресурсами страну, культуру учебного труда, аккуратность, внимание про проведении эксперимента.
Цели:
- Сформировать представление о физических и химических свойствах алюминия.
- Развивать умения учащихся прогнозировать свойства вещества на основе знаний о его строении.
- Развивать умения проводить анализ, сравнение, обобщение данных.
Ход урока
I. Организационный момент
II. Побуждение к изучению темы
В 13-ой квартире живу, известный в мире
Как проводник прекрасный,
пластичен, серебрист.
Еще по части сплавов
Завоевал я славу, -
И в этом деле я крутой специалист.
Вот мчусь я словно ветер
В космической ракете.
Спускаюсь в бездну моря –
Там знают все меня.
По внешности я видный,
Хоть плёнкою оксидной
Покрыт: она мне прочная броня.
Я мягкий, легкий, ковкий,
Сверкаю в упаковке
(Обернуты конфеты блестящею фольгой):
Для плиток шоколада
Меня немало надо,
А раньше был я очень дорогой.
Учитель: Итак, мы последуем за словами этого стихотворения и рассмотрим свойства этого чудесного металла, алюминия.
III. Положение алюминия в таблице Д.И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главное «А» подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al)=27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний, который уже не является металлом. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными, что мы докажем химическими реакциями в ходе лабораторной работы.
Al + 13)2)8)3, p-элемент,
| Основное состояние 1s22s22p63s23p1 |
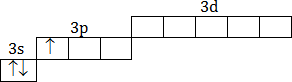 |
| Возбужденное состояние 1s22s22p63s13p2 |
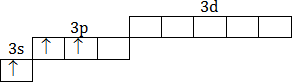 |
Алюминий проявляет в соединениях степень окисления +3: Al0 – 3 e-—> Al+3 (восстановитель)
IV. Нахождение в природе
По распространенности в природе алюминий занимает первое место среди металлов и третье место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах): коллекция соединений алюминия.
Некоторые из них:
- Бокситы, Al2O3·H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины, KNa3[AlSiO4]4
- Алуниты, KAl(SO4)2·2Al(OH)3
- Глиноземы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд, Al2O3
- Полевой шпат (ортоклаз), K2O·Al2O3·6SiO2
- Каолинит, Al2O3·2SiO2·2H2O
- Алунит, (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Берилл, 3BeO·Al2O3·6SiO2
Интересные факты из истории открытия алюминия, которые нашли и подготовили ученики.
1-й ученик: В 1855 году на Всемирной выставке в Париже было представлено «серебро из глины», которое произвело большую сенсацию. Это были пластины и слитки из алюминия, полученного французским ученым Сент-Клер Девилем. К чести Девиля, он поступил как подобает настоящему ученому: из алюминия собственного производства он отчеканил медаль с портретом Фридриха Велера и датой «1827» и послал ее в подарок немецкому ученому, который смог выделить крупинки этого металла. Впервые несколько килограммов металлического алюминия получил в 1825 году датский физик Г.Эрстед действием амальгамы калия на хлорид алюминия, однако тогда не удалось точно установить, какой продукт был получен.
2-й ученик: В пробе лунного грунта, взятой автоматической станцией «Луна-20» с лунной поверхности, впервые был обнаружен самородный алюминий. При исследовании лунной фракции были выявлены три крохотные частицы алюминия. Это плоские, слегка удлиненные крупицы с матовой поверхностью и серебристо-серые в свежем изломе. Алюминий – лунный камень. В земных же условиях природный чистый алюминий в столь миниатюрном виде так и не найден.
V. Физические свойства алюминия
Учитель: Перейдем к изучению простого вещества алюминия.
Лабораторная работа «Физические свойства алюминия».
Инструктивная карта:
- Рассмотрите алюминиевую пластинку.
- Определите агрегатное состояние вещества алюминия.
- Какого цвета пластинка?
- Определите, имеет ли данная пластинка блеск.
- Опустите пластинку на ¼ ее длины в стакан с горячей водой на 10-15 секунд. Вытащите пластинку из воды, протрите салфеткой и определите, обладает ли алюминий теплопроводностью.
- Возьмите в руки алюминиевую фольгу. Определите, обладает ли алюминий пластичностью. Легкий ли это металл?
- Поместите в стакан с холодной водой алюминиевую пластинку, проверните ее несколько раз. Наблюдается ли растворение алюминия?
- Кратко запишите свои наблюдения согласно плану:
- агрегатное состояние;
- цвет;
- блеск;
- теплопроводность;
- пластичность;
- растворимость в воде.
На доске выписаны некоторые дополнительные сведения о свойствах алюминия:
- легкий, p = 2,7 г/см3;
- легкоплавкий, t пл = 660°С
- электропроводный (лишь два металла – серебро и медь – имеют более высокие показатели)
Хотя алюминий является активным металлом, в воде он не растворяется, так как его поверхность покрыта плотной непористой оксидной пленкой.
VI. Химические свойства алюминия
Учитель: Как всякий металл в химических реакциях алюминий проявляет восстановительные свойства.
Реакции с простыми веществами:
2Al + 3S = Al2S3 (сульфид алюминия)
2Al + N2 = 2AlN (нитрид алюминия)
Al + P = AlP (фосфид алюминия)
4Al + 3С = Al4C3 (карбид алюминия)
2Al + 3I2 = 2AlI3 (йодид алюминия)
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Al + 3O2 = 2Al2O3 + 1676 кДЖ
Реакции со сложными веществами:
Взаимодействие с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
без оксидной пленки
ОПЫТ
Взаимодействие с оксидами металлов:
Алюминий хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например, таких, как вольфрам, ваннадий и другие.
3Fe3O4 + 8Al = 4Al2O3 + 9Fe +Q
Лабораторная работа учащихся выполняется в течение 10-15 минут по инструктивным картам.
Инструктивная карта:
- Возьмите две пробирки. В каждую положите по кусочку алюминия. Прилейте в одну из них 1-2 мл раствора соляной кислоты, а в другую – столько же раствора разбавленной серной кислоты. Пробирки слегка нагрейте. Что наблюдаете? Запишите уравнение соответствующих реакций.
- В пробирку поместите кусочек алюминия и прилейте раствор щелочи. Содержимое пробирки нагрейте. Что происходит? Запишите уравнение реакции.
Работа с книгой: раздел «Химические свойства алюминия». Инструктивные карты сдаются в конце урока.
Вывод: алюминий, а значит, и его соединения проявляют амфотерные свойства.
VII. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3 как вода растворяет сахар.
Электролиз «раствора» оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия – электролитом.
эл.ток
2Al2O3 —> 4Al + 3O2
В настоящее время по объему производства алюминий прочно занимает среди металлов второе место после железа и его сплавов. Для выплавки 1 тонны алюминия требуется 13-17 тысяч кВт/час электрической энергии, поэтому алюминиевые заводы расположены вблизи крупных ГЭС.
В английской «Энциклопедии для мальчиков и девочек» статья об алюминии начинается следующими словами: «23 февраля 1886 года в истории цивилизации начался новый металлический век – век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах». Так, Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем как человек, сделавший из науки великолепный бизнес.
2) 2Al2O3 + 3C = 4Al + 3CO2
VII. Применение алюминия
Учитель демонстрирует презентацию по алюминиевым сплавам. Ученики рассматривают коллекцию сплавов на основе алюминия.
Применение в технике: крупным потребителем алюминия является авиационная промышленность – самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров, поэтому алюминий называют «крылатым» металлом. Из алюминия изготавливают кабели и провода: при одинаковой электрической проводимости их масса в два раза меньше, чем у соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготавливают детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей: такой краской покрывают нефтехранилища, костюмы пожарных.
Алюминий широко применяется в таких областях, как ядерная энергетика, полупроводниковая электроника, радиолокация. Его используют для защиты металлических поверхностей от химической и атмосферной коррозии. Отражающие поверхности нагревательных и осветительных рефлекторов и зеркал своим существованием также часто обязаны алюминию – его высокой светоотражающей способности.
Алюминий применяется и в металлургической отрасли промышленности в качестве восстановителя при получении некоторых метталов аллюмотермическими методами, для сварки стальных деталей или раскисления стали. Применяется алюминий и его сплавы также в промышленном и гражданском строительстве, при изготовлении каркасов зданий, ферм, оконных рам, лестниц и других конструкций.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств (маалокса, альмагеля), которые понижают кислотность желудочного сока.
Учитель: Итак, мы сегодня познакомились с чудесным металлом:
Из глины я обыкновенной,
Но я на редкость современный.
Я не боюсь электротока,
Бесстрашно в воздухе лечу,
Служу на кухне я без срока –
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я … (Алюминием).