Тип урока. Изучение нового материала.
Цели урока:
- образовательные: дать понятие о водороде и его свойствах, раскрыть связь между химическими свойствами и областями применения;
- развивающие: развивать познавательную активность, аналитико-синтетического мышления, самостоятельности, умения работать в парах и группах, вести наблюдения и делать выводы;
- воспитательные: формирование познавательного интереса к предмету через использование нестандартных форм обучения и создание ситуации успеха.
Задачи урока:
закрепить умения работы с
учебником, анализировать, систематизировать,
обобщать и структурировать новый материал;
Формирование ключевых компетенций на уроке.
уметь ставить цель,
пояснить её, планировать работу, выбирать
главное в тексте, организовывать анализ,
рефлексию и самооценку своей деятельности.
Метод: технология развития критического мышления.
Методические методы и приёмы: проблемно-поисковый, традиционные словесные – беседа, диалог, самостоятельная работа с учебной литературой, мультимедийными слайдами, химический эксперимент, составление опорных схем, “покопаемся в памяти”, “ромашка Блума”, работа в группах, фронтальные задания, самопроверка.
Оборудование и реактивы: гранулы цинка, раствор соляной кислоты, пробирки, спички, спиртовки, аппарат Киппа, прибор Кирюшкина.
Дидактический материал: портреты Г.Кавендиша и А.Лавуазье, мультимедийная установка, карточки “Согласен – не согласен” для групп, вопросы “ромашки Блума”, карточки саморефлексии.
Ход урока
I. Организационный момент (1 минута)
1. Приветствие.
2. Проверка готовности к уроку.
II. Стадия вызова (5 минут)
Учитель. Прослушайте информацию и сформулируйте тему урока. В средние века химики называли это вещество “горючим газом”. Это самый распространённый элемент в космосе – из каждых 10 атомов Вселенной на его долю приходится 8%. Наше Солнце более чем наполовину состоит из этого вещества.
В 1784 году французский химик А. Лавуазье доказал, что это не “горючий газ”, а вещество и дал этому элементу название “гидрогениум”, что означает “рождающий воду”. Это вещество - водород. Вы назвали тему сегодняшнего урока: “Водород”.
Учитель. Что вы знаете о нём? (Заслушиваются ответы учащихся).
Учитель. Вам предложены в карточках утверждения о водороде. Ваша задача – обсудить их в группах и поставить напротив каждого утверждения “+” если согласны и “ - ” если не согласны, если мнения разошлись - “?”.
(Учащиеся работают 3 минуты, затем заслушиваются ответы)
Учитель. Как видите, у вас получились разные ответы. Исходя из данных утверждений, определите цель урока. (Изучить водород как элемент и простое вещество)
Сформулируйте задачи урока с помощью слов-помощников или предложите свои, которые помогут решить вашу цель. (Слова-помощники “определить, изучить, оформить, повторить” записаны на доске: изучить, повторить, определить, составить)
III. Изучение нового материала
Учитель. Чтобы изучить новый материал, предлагаю представителям групп выбрать лепесток ромашки, содержащий определённый тип вопроса.
Работать будете в группах по карточкам с вопросами. Информацию ищете в параграфе 19 на страницах 136-140 учебника. На подготовку ответов выделяется 10 минут. Во время работы каждая группа составляет свой опорный конспект. Затем слушаем отчеты групп. Записываем химические реакции на доске в свете ОВР.
(Физкультминутка (2 минуты). Гимнастика для глаз : Мысленно с красной точки провести по окружности. (окружность - S-облако атома водорода с электроном(красная точка)
Учитель. Итак, водород относится к неметаллам. Каковы же особенности у неметалла водорода? Почему химики этому элементу в периодической системе отвели два места?
Учащийся группы 1 рассказывает о строении атома водорода, его положении в ПСХЭ и делает записи на доске, остальные вносят в свои тетради.
Учитель. Какое строение имеет водород как простое вещество?
Учащийся группы 2 рассказывает о строении молекулы водорода, ковалентной неполярной связи.
Учитель. Раз атом водорода способен отдавать и принимать электроны, следовательно, какие химические реакции для него характерны?
Учащийся группы 3 рассказывает о химических свойствах водорода.
Демонстрация реакции “Медное зеркало”
Задание классу. Заполните таблицу правую часть уравнений химических реакций, определите, где водород восстановитель, где – окислитель.
(Учащиеся рассматривают данные реакции как окислительно-восстановительные и проводят последующую самопроверку )
Учитель. В 1766 году английский физик и химик Г. Кавендиш собрал чистый водород и поэтому его считают первооткрывателем водорода. (Учитель обращает внимание учащихся на портрет Г. Кавендиша) Какие существуют способы получения водорода?
Учащийся группы 4 рассказывает о способах получения водорода в промышленности и лаборатории, записывает алгоритм получения водорода, используя кислоту и цинк .
Учитель. Используя химическую посуду у вас на столах, получите водород, соберите и докажите его наличие.
Лабораторный опыт. Учащиеся по предложенному учащимися 4 группы алгоритму выполняют химический эксперимент.
Учитель. Смесь Н2 и О2 в отношении 2:1 взрывоопасна, поэтому водород заменяется безопасным гелием. В лаборатории эту смесь сжигают в приборе, который называется эвдиометр. (Демонстрируется видеоролик)
Учитель :корреспонденты задают вопросы учёному- химику о применении водорода.( Журнал “Наука и техника” вопрос: Спасёт ли нас водород от экологической катастрофы? Журнал “Юный натуралист” вопрос: Что общего у жука- бомбардира с водородом? Журнал “Юный техник” вопрос: В каких механизмах человек использует свойства водорода? Журнал “Мир фантастики” вопрос: Что известно о водородной бомбе?
Учащийся группы 5 рассказывает о физических свойствах водорода областях его применения.
IV. Рефлексия (6 минут)
Учитель. Итак, сегодня вы познакомились с одним из самых интересных элементов периодической системы – водородом. Для того чтобы проверить, над чем ещё вам нужно поработать, снова обратимся к суждениям “согласен – не согласен”.
Учитель суммирует ответы групп, и предлагает учащимся сделать вывод по цели и задачам урока.
Для проведения саморефлексии учащимся раздаются карточки, в которых предлагается ответить на предложенные учителем вопросы.
V. Домашнее задание: Параграф 19, № 4 на стр. 142 всем, № 3 на стр. 142, занимающимся на “4” и “5”.
VI. Итог урока (2 минуты)
Учитель консультирует учащихся по выполнению домашнего задания, выставляет оценки.
Литература
1. Габриелян О.С
. Химия. 9 класс: учеб. для общеобразоват. Учреждений / О.С.Габриелян. – 3-е изд., стереотип. – М.: Дрофа, 2015.2.Горковенко М.Ю
. Химия. 8 класс: Поурочные разработки к учебникам О.С.Габриеляна; Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой; Г.Е.Рудзитиса, Ф.Г.Фельдмана. – М.: ВАКО, 2004.3. Учебно-методическая газета для учителей “Химия” Издательский дом “ Первое сентября”: №10, 24 2008 год: № 2 2009 год.
4. Муштавинская И.В., Трофимчук Г.А. Технология развития критического мышления: Методическое пособие.– СПб: ИРО “Смена”, 2004.
5. http://www.kmspb.narod.ru./posobie/priem.htm Приемы технологии РКМ.
Карточка “согласен – не согласен”
| Суждения о водороде | Согласен “+” Не согласен “-” |
| 1. Водород занимает в ПСХЭ два места, потому что он является самым легким газом | |
| 2. У него всегда степень окисления равна +1 | |
| 3. Атомы водорода в молекуле удерживаются ковалентной неполярной связью | |
| 4. Водород хорошо растворяется в воде | |
| 5. В реакциях он может выступать в роли окислителя | |
| 6. Водород восстанавливает металлы из их оксидов | |
| 7. Водород получается при взаимодействии металла с кислотой | |
| 8. Его можно собрать, только держа пробирку дном вверх | |
| 9. Водород горит с взрывом с образованием воды | |
| 10. Водород – это топливо будущего |
Вопросы “ромашки Блума”
Группа 1. Объясняющие вопросы.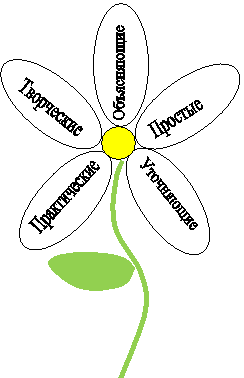
Объясните, почему элемент водород в ПСХЭ занимает два места?
Группа 2. Простые вопросы.
Какое строение имеет молекула водорода?
Группа 3. Уточняющие вопросы.
Обычно водород проявляет степень окисления +1 и значит, является восстановителем, может ли он быть окислителем? Докажите это с помощью уравнений химических реакций.
Группа 4. Практические вопросы.
Составьте алгоритм получения водорода с помощью аппарата Кирюшкина. Можно ли с помощью такого аппарата получать водород в промышленных масштабах?
Группа 5. Творческие вопросы.
Водород – перспективное топливо для двигателей внутреннего сгорания. Какие преимущества имеет водород в качестве топлива на транспорте?
Вопросы саморефлексии учащихся
| 1. Оцените свою работу на уроке по
пятибалльной шкале. 2. Оцените по шкале, как усвоили материал
3. Понравилось ли работать с данным типом вопросов “ромашки”? 4. С какими вопросами хотелось бы работать на следующих уроках? |
||||||||||||||||||||||||||||||
Слайды компьютерной презентации
| Слайд 1 Заполните правую часть уравнений реакций, определите, где водород восстановитель, где – окислитель H2 + O2 = H2 + S = H2 + Cl2 = H2 + К = H2 + Ca = H2 + WO3+ = |
Слайд 2 2H20 + O2 0= 2H2+O-2 в- ль H20 + S0 = H2+ S-2 в- ль H20 + Cl20 =2H+Cl- в- ль H20 + 2K0 = 2K+H- ок- ль H20 + Ca 0=Ca+2H2- ок- ль 3H20 + W+6O3 -2=3H2+O-2 + W0 в- ль |
| Слайд 3 Демонстрация получения водорода с помощью аппарата Киппа |
Слайд 5
|
| Слайд 4 Демонстрируется эвдиометр |