Опыт использования модульной технологии показывает, что каждый ученик может выбирать свой темп изучения материала, достигать результата на доступном ему уровне, работать в ситуации успеха, осваивать и совершенствовать не только общеучебные, но и специальные умения, что свидетельствует о формировании универсальных учебных действий. Обучающиеся самостоятельно умеют работать с разными источниками информации, составлять схемы, конспекты, рисунки, записывать уравнения химических реакций, решать расчетные и экспериментальные задачи, находить правильные пути выхода из сложных ситуаций, что ведет к совместной продуктивной деятельности педагога – ученика. В ходе модульных уроков неоднократно убеждаюсь, что обучающиеся могут вести конструктивный обмен мнениями, понимать, логически рассуждать, сравнивать, анализировать, делать выводы не только индивидуально, но и в коллективе, что говорит о формировании социальной и коммуникативной компетентностях.
В качестве примера предлагаю разработку модульного урока в 9-м классе по теме «Путешествие в мир органических кислот» (Химия. 9 класс: учебник для ОУ / О.С. Габриелян. – 14 изд. испр. – М.: Дрофа, 2008. -270, [2] с.: ил.)
- УЭ – Учебный элемент
- УЭ0 – Интегрирующая цель
- УЭ1 – Входной контроль: проверка знаний, умений, подготовка к восприятию нового материала
- УЭ2 – Понятие о предельных одноосновных кислотах
- УЭ3 – Химические свойства предельных одноосновных кислот на примере уксусной кислоты
- УЭ4 – Органические кислоты – родственники уксусной кислоты. Состав, применение
- УЭ5 – Выходной контроль
- УЭ6 – Рефлексия
Ход урока
УЭ |
Учебный материал с указанием заданий |
Указания к выполнению работы |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ0 |
Интегрирующая цель:
Условия работы:
|
На доске: Тема: «Путешествие в мир органических кислот». Дома: §36 с. 217–219, упр. 1 с. 220. Время работы – 1 минута |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ1 |
Цель: проверить усвоение знаний о ранее изученных органических веществах. Задание 1 (для всех)
Задание 2 (по вариантам)
|
Фронтальная работа в классе Время работы – 5 минут
Время работы – 4 минуты Контроль: сверить ответы (см. слайд) «5» – нет ошибок; «4» – одна ошибка. |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ2 |
Цель: дать понятие о предельных одноосновных карбоновых кислот. Внимательно выслушать объяснение учителя |
Время работы – 4 минуты Рассказ учителя (презентация): составление краткого конспекта |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ3 |
Цель: исследовать вопрос, могут ли органические кислоты обладать похожими свойствами с неорганическими; продолжить формирование умений проводить опыты, наблюдать, анализировать, выделять главное, делать выводы. Оборудование и реактивы: штатив с пробирками, растворы уксусной кислоты, гидроксида натрия, фенолфталеина; метилоранжа; цинк (пробирка № 1), оксид кальция (пробирка № 2), карбонат натрия (пробирка № 3); пластина с гнездами. Инструктаж по технике безопасности Объект исследования – уксусная кислота. Опыт 1. Определите природу раствора с помощью индикатора: в гнездо пластины внесите 2 капли уксусной кислоты и одну каплю метилоранжа. Какую окраску имеет раствор? Напишите уравнение диссоциации. Опыт 2. В пробирку № 1, где находится гранула цинка, налейте 1-2мл (10 капель) уксусной кислоты. Что наблюдаете? Напишите уравнение по схеме:
Опыт 3. В пробирку № 2, где находится оксид кальция – порошок белого цвета, налейте 1-2 мл уксусной кислоты. Что наблюдаете? Произошло ли растворение оксида кальция? Если растворение произошло не до конца, добавьте еще 1 мл уксусной кислоты. Напишите уравнение по схеме:
Опыт 4. В гнездо пластины внесите 2 капли гидроксида натрия, одну каплю фенолфталеина. Какая окраска раствора? Добавьте две капли уксусной кислоты. Произошло ли обесцвечивание? Объясните, почему окраска исчезла. Напишите уравнение по схеме: Основание + Уксусная кислота → Соль + Вода. Опыт 5. В пробирку № 3, где находится небольшое количество карбоната натрия, налейте 1-2 мл уксусной кислоты. Что увидели? Напишите уравнение реакции по схеме:
Сделайте вывод: похожи ли свойства органических кислот на свойства их неорганических родственников. |
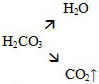
Время работы – 15 минут Работа в ППС При выполнении лабораторных опытов воспользуйтесь таблицей «Растворимость оснований, солей в воде». ПОМНИТЕ: соли уксусной кислоты называют ацетаты. ПОМНИТЕ: угольная кислота – слабый электролит:
Уборка рабочего места: аккуратно поставьте пластину, штатив с пробирками около лотка, проверьте все ли реактивы стоят на месте. |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ4 |
Цель: познакомить с органическими кислотами – родственниками уксусной кислоты. Задание: на основе предложенных массовых долей химических элементов, относительной плотности определить формулы карбоновых кислот.
Сделайте вывод: можно ли назвать данные родственниками уксусной кислоты. |
Работа в группах 3 минуты. Решение задач с последующей проверкой. Сообщения учащихся о кислотах. |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ5 |
Цель: проверить усвоение знаний о карбоновых кислотах. Задание 1 (для всех)
Задание 2 (для всех) С какими из перечисленных веществ реагирует муравьиная кислота: магний, медь, оксид меди (II), сульфид натрия. Напишите уравнения возможных реакций. Задание 3 (для всех) По предложенной схеме напишите уравнения химических реакций:
|
Время работы – 7 минут
Индивидуальная работа каждого ученика
Постарайтесь выполнить по возможности все задания
Контроль: проверяет и оценивает учитель |
||||||||||||||||||||||||||||||||||||||||||||||||
УЭ6 |
– Доволен ли ты собой? – В чем польза этого урока для тебя?
|
|
||||||||||||||||||||||||||||||||||||||||||||||||