Решение задач – один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии и вырабатывается умение самостоятельного применения приобретенных знаний. Решение задач связано со сложной мыслительной деятельностью. На ЕГЭ и вступительных экзаменах в высшие учебные заведения высокой оценки, как правило, добиваются те абитуриенты, которые справляются с задачами повышенной сложности.
Методика обучения учащихся количественным расчетам должна включать несколько этапов:
1) накопление теоретических знаний;
2) обучение отдельным операциям и действиям, которые входят в общую деятельность по решению задач;
3) решение и составление типовых задач;
4) решение разнообразных задач повышенной сложности.
При обучении химии в 8-м классе учащиеся приобретают навыки решения задач определенных типов. Именно с начального момента обучения следует прививать умения выполнять отдельные операции решения, которые учащиеся могут применить в новых ситуациях. После изучения темы «Относительная молекулярная масса» решаются задачи на вычисление относительных молекулярных масс, массовых отношений химических элементов в сложном веществе, нахождение массовой доли химических элементов в сложном веществе, вывод химических формул, если известны массовые доли химических элементов, входящих в состав данного вещества. Здесь можно предложить следующие задачи.
Задача 1. Найдите относительные молекулярные массы:
а) гексагидрата хлорида кальция СаСl2 * 6Н2О;
б) медного купороса CuSO4 * 5H2О;
в) хромокалиевых квасцов K2SО4 * Cr2(SO4)3 * 24H2O.
Задача 2. Вычислите массовую долю кристаллизационной воды в дигидрате сульфата кальция CaSO4 * 2Н2О.
Задача 3. Выведите простейшую формулу соединения, в котором мaccoвые доли натрия, фосфора и кислорода равны 34,6 %, 23,3 %, 42,1 % соответственно. Вычислите относительную молекулярную массу этого соединения.
В теме «Количество вещества. Моль. Молярная масса» вводится новая величина – постоянная Авогадро. Следует дать разъяснение по поводу вывода этой величины.
Масса атома углерода: m(C) = 1,995 * 10–26 кг, М(C) = 0,012 кг/моль.
Найдем число атомов, содержащихся в 1 моль углерода:
NA= M(C) / m(C) = 0,012 (кг/моль) / (1,995 * 10–26(кг)) = 6,02 * 1023 моль–1.
Moлярную массу связываем с NA, например:
М(Н2О) = m(Н2О) * NA = 3*10–23 (г) * 6*1023 (моль–1) = 18 г/моль.
На этом же уроке даются следующие формулы:
ν= N/NA, ν= m/M,
где ν – количество вещества.
Учащимся можно дать задачи следующего типа на применение данных формул и постоянной Авогадро.
Задача 1. Рассчитайте массу:
а) кислорода количеством вещества 0,5 моль;
б) 1,202 * 1024 молекул кислорода.
Задача 2. Определите число структурных единиц в воде массой 54 г.
Школьникам предлагается заполнить таблицу «Количественная характеристика вещества».
Таблица. Количественная характеристика вещества
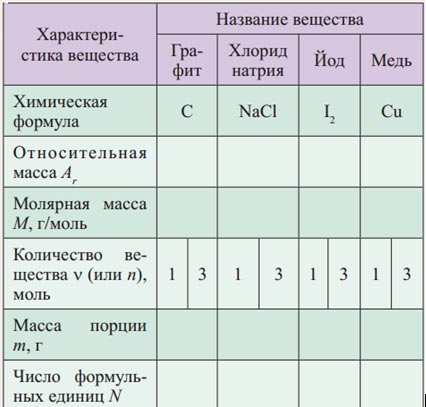
В 8-м классе учащиеся должны приобрести умения составлять количественные соотношения реагентов и продуктов реакции по химическим уравнениям:
k1A + k2В= k3C + k4D.
Из уравнения следует, что νA / νB = k1 / k2, νB / νС= k2 / k3 и т.д.
Это отношение в будущем применяется при нахождении количества вещества, которое полностью вступило в реакцию. Следующим шагом будет нахождение количества вещества исходных веществ или продуктов реакции по условию задачи.
Задачи на расчеты по термохимическим уравнениям также не вызывают больших затруднений. Учащихся нужно познакомить с понятием «энтальпия» и законом Гесса. Здесь можно использовать схему-конспект «Тепловой эффект и энтальпия реакции».
Q– А+ B = 2C + Q,
эндотермическая экзотермическая
где Q – тепловой эффект химической реакции.
2Н2 (г.) + О2 (г.) = 2Н2О(г.) + 484 кДж – термохимическое уравнение.
ΔrН – энтальпия химической реакции;
ΔfН – энтальпия образования вещества
{А+ В= 2С} + Q – экзотермический эффект (выделение теплоты, ΔrНº < 0).
{2С= А+ В} – Q – эндотермический эффект (поглощение теплоты, ΔrНº > 0).
– Δr Н = +Q и ΔrН = – Q.
Закон Гесса:
Δr Нº = ∑Δf Нº (прод.) – Δf Нº (реаг.).
П р и м е р: А+ В= 2С, Δr Нº = 2Δf Нº (С) – [Δf Нº (А) + Δf Нº (B)].
Учащимся предлагаются задачи следующего типа:
Задача 1. При образовании 1 моль водяного пара из водорода и кислорода выделяется 242 кДж теплоты. Сколько выделится теплоты, если в реакцию вступит 0,2 г водорода?
Задача 2. Сколько теплоты выделится при сгорании 1 кг кокса, содержащего 10 % примесей, если при сгорании 1 моль углерода выделяется 393,5 кДж теплоты?
Большой интерес представляют задачи на растворы. Здесь учащиеся должны свободно владеть следующими формулами:
ωр.в. = mр.в. /mр-ра * 100 (%);
с= ν/Vр-ра.
При разбавлении растворов:
ωр.в. = mр.в. /(mр-ра + mH2O) * 100(%).
При выпаривании растворов:
ωр.в. = mр.в. / (mр-ра – mH2O) * 100 (%).
При смешивании растворов:
ωр.в. = (mкр.в. + mрр.в.) / (mкр-ра + mрр-ра) * 100 (%),
где mкр.в. – масса вещества в концентрированном растворе;
mрр.в.– масса вещества в разбавленном растворе;
mкр-ра – масса исходного концентрированного раствора;
mрр-ра – масса исходного разбавленного раствора.
Используя данные формулы, можно решать задачи разного типа.
Задача 1. Смешали 100 г раствора с массовой долей гидроксида натрия 0,05 и 200 г раствора с массовой долей гидроксида натрия 0,15. Вычислите массовую долю гидроксида натрия в полученном растворе.
Задача 2. Сколько граммов раствора серной кислоты с массовой долей 0,2 следует добавить к 500 г раствора этой кислоты с массовой долей серной кислоты 0,5, чтобы получить раствор серной кислоты с массовой долей 0,3?
Задача 3. Сколько глауберовой соли Na2SO4 * 10H2O нужно добавить к 250 г воды, чтобы получить раствор с массовой долей безводной соли 0,05?
Задача 4. К 150 г 5%-го раствора соли прилили 70 г 20%-го раствора этой же соли, затем долили 50 г воды, добавили 15 г соли, выпарили 10 г воды. Какова массовая доля соли в полученном растворе?
Задача 5. Прокипятили 4,2%-й раствор гидрокарбоната натрия. Определите массовую долю вещества в полученном растворе. Испарением воды пренебречь.
Задача 6. Сколько мл 40%-го раствора азотной кислоты (плотность 1,4 г/см3) потребуется для по-лучения 300 мл раствора с молярной концентрацией 0,1 моль/л?
Далее рассматриваются задачи с использованием молярного объема, относительной плотности газов, объемных отношений газов при химических реакциях. Вводятся новые формулы:
ν= V/ VM; DH 2= Mr/ 2; Dвозд= Mr/ 29
ρ= M / VM; ρ= m/V.
В химических реакциях с газообразными веществами необходимо ycвоить:
аA + вВ= cC + dD,
VA/ VB = а/ в, VA/ VC = а/ c
и т.д.
При использовании закона объемных отношений газов расчеты упрощаются.
Задача 1. Рассчитайте массу 2 л (н.у.) кислорода (ρ= 1,429 г/л).
Задача 2. Определите число молекул кислорода в 11,2 л этого газа (н.у.).
Задача 3. Какой объем при н.у. займут: а) 1,5 моль азота; б) 42 г азота; в) 1,2*1026 молекул азота?
Задача 4. При сжигании 200 мл газообразного углеводорода израсходовано 700 мл кислорода и об-разуется 400 мл оксида углерода(IV). Установите молекулярную формулу углеводорода.
В теме «Скорость химических реакций. Химическое равновесие» даются формулы для нахождения скорости химических реакций:
v= ±Δc/ Δt.
По закону действующих масс для реакции
аA + вВ= cC + dD
cкорость определяют по формуле:
v= k * сaA * свВ,
где сA, сВ – молярные концентрации газообразных веществ А и В,
k – константа, равная скорости реакции при концентрации веществ 1 моль/л (справочная величина).
При объяснении зависимости скорости химической реакции от температуры ученикам следует дать математическое выражение правила Вант-Гоффа:
v2= v1 * γ (t2 –t1)/10,
где γ – температурный коэффициент.
Полученные знания учащиеся используют при решении задач следующего типа.
Задача 1. Как изменится скорость реакции N2+ 3Н2 = 2NН3 при увеличении концентрации водорода в 3 раза?
Задача 2. Как изменится скорость химической реакции 2А + В = С при увеличении концентрации вещества А в 2 раза и одновременном уменьшении концентрации вещества В в 2 раза?
Задача 3. В сосуде объемом 2 л смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль (н.у.). Газы А и В реагируют в соответствии с уравнением А + В = С. Через 20 с в системе образовался газ С количеством вещества 2 моль. Определите среднюю скорость реакции. Какие количества непрореагировавших газов А и В остались в системе?
Комбинированные задачи, в которых присутствуют различные операции, входящие в общую деятельность по решению задач. Между физическими величинами необходимо устанавливать прямую непосредственную связь: ν– m, m–ν, ν–V, ν–N и т.д. Это принцип рацинальности расчетов. Взаимосвязь физических величин учащиеся выражают следующими схемами:
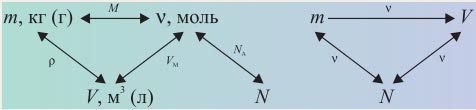
Учащимся предлагаются следующие задачи.
Задача 1. В 100 мл воды растворили 0,56 л оксида серы(IV) (н.у.). Найдите массовую долю образовавшейся в растворе кислоты.
Задача 2. Какой станет массовая доля вещества в растворе, если к 100 г раствора гидроксида лития с массовой долей 10 % добавить 10 г металлического лития?
Задача 3. Оксид марганца(IV) реагирует с 10%-м раствором соляной кислоты (ρ= 1,05 г/мл) с образованием хлора. Выделившийся хлор полностью прореагировал с 200 г 10,3%-го раствора бромида натрия. Определите объем выделившегося хлора, расход оксида марганца(IV) (в г) и раствора соляной кислоты (в мл) в реакции.
Расчёты по уравнениям с неполным реагированием (разложением) исходных веществ.
Задача 1. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 63,2 г. Твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20% раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
Пояснение:
Часть гидрокарбоната разложилась, остальная прореагировала с НCL
Осадок: (Na2CO3 и NaHCO3 остаток) их m = 63,2 г; HCl реагирует с Na2CO3 и NaHCO3; СО2 выделится из раствора.
Решение
| 0,2 моль | 0,2 моль | ||
| 2NaHCO3 = | Na2CO3 + | СО2 |
Н2О |
| 0,5 моль | 0,5 моль | 0,5моль | 0,5моль | |
| NaHCO3 + | НСl = | NaСl + | СО2 |
Н2О |
| 0,2моль | 0,2моль | 0,2моль | 0,2моль | |
| Na2CO3 + | 2НСl = | 2NaСl + | СО2 |
Н2О |
(m (р-ра) = m(осадка) + m(НСl) – m(СО2))
Определяем nСО2 по данным из условия задачи.
n(СО2)1р. = V/Vm = 4,48/22,4 = 0,2 моль
n(Na2CO3) = n(СО2) = 0,2 моль (т.к. их соотношение 1:1)
m(Na2CO3) = n*M = 0,2 *106 = 21,2 г.
m(NaHCO3) остаток = 63,2 – 21,2 = 42 г.
n(NaHCO3)остаток = m/M = 42/84 = 0,5 моль
Количество вещества НСl находим из реакций 2 и 3
n(НСl) = n (NaHCO3) + 2 n(Na2CO3) = 0,5 + 2*0,2 = 0,9 моль
m(НСl)в. = 0,9* 36,5 = 32,85г.
m(НСl)р-ра = 32,85/0,2 = 164,25г.
n(NaСl) = n(НСl) = 0,9 моль
m(NaСl) = 0,9 *58,5 =52,65 г.
n(СО2)2я, 3я р. = 0,5 + 0,2 = 0,7 моль
m(СО2) = 0,7 * 44 = 30,8 г.
m(р-ра) = 63,2 + 164, 25 – 30,8 = 196,65 г
W(NaСl) =52,65/196,65 = 0,268 (26,8%)
Задача 2. Водород объёмом 6,72 л (н. у.) пропустили при нагревании над порошком оксида меди(II), при этом водород прореагировал полностью. В результате реакции получили 20,8 г твёрдого остатка. Этот остаток растворили в концентрированной серной кислоте массой 200 г. Определите массовую долю соли в полученном растворе.
| 0,3 моль | 0,3 моль | ||
| CuO + | H2 = | Cu + | Н2О |
| 0,02моль | 0,02моль | ||
| CuO + | Н2SО4 = | CuSО4+ | 2Н2О |
| 0,2моль | 0,3 моль | |||
| Cu + | Н2SО4 = | CuSО4 + | SO2 |
2Н2О |
( m (р-ра) =m(остатка) + m(Н2SО4)р-ра - m SO2
n(H2) = 6,72/22,4 = 0,3 моль
n(H2) = n(Сu) = 0,3 моль; m(Сu) = 0,3*64 = 19,2г.
m(СuО) остаток = 20,8 - 19,2 = 1,6 г
n(СuО) остаток = 1,6/80 = 0,02 моль
n(CuSО4)2 р-я = n(СuО) остаток = 0,02моль
n(CuSО4)3 р-я = n(Сu) = 0,3 моль;
n(CuSО4)общая = 0,02 + 0,3 = 0,32 моль
m(CuSО4) = 0,32 *160 = 51,2г
n(SO2) = n(Сu) = 0,3 моль
m(SO2) = 0,3*64 = 19,2 г
m(р-ра) = 20,8 + 200 - 19,2 = 201,6 г
W(CuSО4) = 51,2/201,6 = 0,254 (25,4%)