План
1. Общая характеристика элементов щелочных металлов по их положению в периодической системе.
2. Нахождение в природе.
3. Получение.
4. Физические свойства.
5. Химические свойства.
6. Соединения щелочных металлов
А) гидроксиды
Б) гидриды, пероксиды, оксиды.
7. Применение щелочных металлов и их соединений.
8. Осуществить превращения
9. Задача 1 стр 126
10. Задание на дом: параграф 47, задача 3 стр. 127
Повторим и запомним
Щелочные металлы образуют главную подгруппу 1 группы и обладают наиболее выраженными металлическими свойствами. Это обусловлено строением атомов щелочных металлов, наружный энергоуровень имеет конфигурацию ns1.
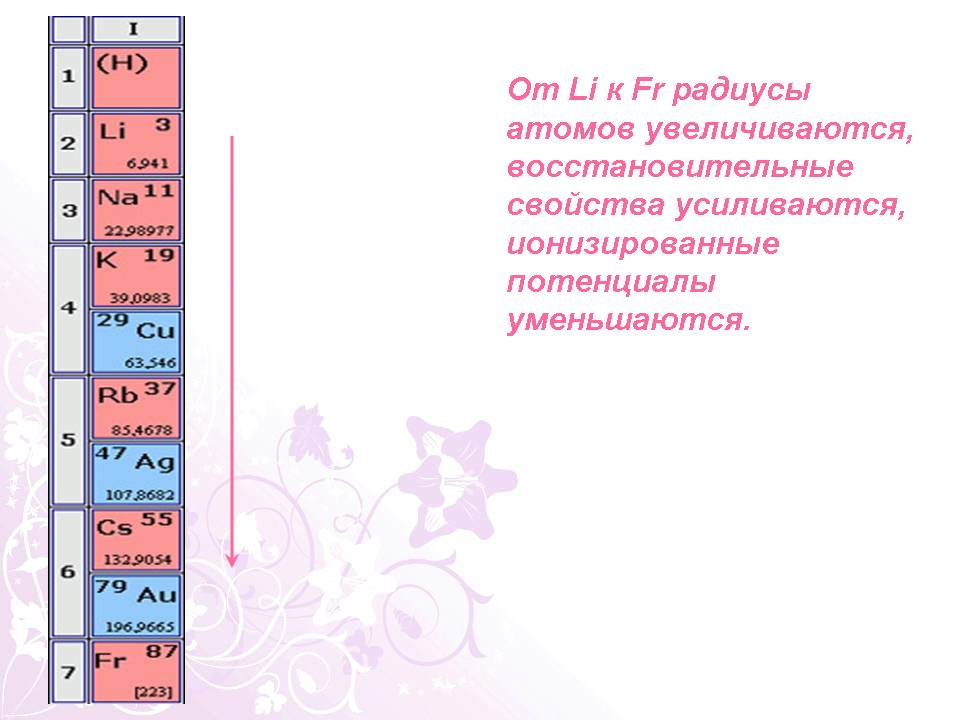
От Li к Fr радиусы атомов увеличиваются, восстановительные свойства усиливаются, ионизированные потенциалы уменьшаются.
Взаимодействуют с неметаллами, водой, кислотами. Из соединений натрия и калия большое значение имеют гидроксиды их, сильные электролиты.
Задачи и цель:
Сегодня на уроке мы вместе изучим новую тему, разберем строение элементов атомов щелочных металлов; опираясь на строение рассмотрим способы получения щелочных металлов, выясним, почему щелочные металлы так называются.
С одной стороны - это новый материал, а с другой стороны - изучение этого материала тесно соприкасается с ранее изученной теорией в 8-9 классов. Поэтому предлагаю построить урок как экскурсию, путешествие по стране химии, а именно по области щелочных металлов и их соединений.
Арабская пословица гласит: "Кто путешествует, тот познает."
Ребята, в ходе экскурсии вы будете и экскурсоводами и экскурсантами. Ответственным за работу экскурсоводов будет главный консультант, он внимательно слушает ответы, оценивает их, анализирует, и если экскурсовод не может ответить на заданный вопрос и другие учащиеся тоже, то тогда отвечает главный консультант.
Итак, начнем урок-экскурсию. На столах лежит план нашей экскурсии. Каждый раздел плана - это лаборатория, которая занимается изучением данного вопроса.
Ну что ж, первая лаборатория, в которую мы попадаем - это, конечно же, лаборатория по изучению строения элементов щелочных металлов и их простых веществ. Кто будет экскурсоводом в этой лаборатории? Кто даст, осветит общую характеристику щелочным металлам?
Краткий рассказ экскурсовода - это подгруппа лития Li.Na. K.Rb. Fr. Cs. Эти элементы находятся в 1-ой группе главной подгруппе, высшая постоянная валентность равна 1, на наружном энергоуровне 1 e, который слабо притягивается к ядру, поэтому атомы щелочных металлов легко его отдают, проявляя степень окисления +1. Это s-элементы. Простые вещества этих элементов называются щелочными металлами. Молекулы щелочных металлов одноатомные, щелочные металлы сильные восстановители, типичные элементы-металлы. Металлические свойства элементов увеличиваются, химическая активность увеличивается т.к.происходит увеличение размера атомов с возрастанием порядкового номера от Li к Fr.
Вопросы к экскурсоводу:
1. Почему щелочные металлы имеют одноатомные молекулы?
2. Какое соединение с кислородом образуют элементы подгруппы лития? Характер соединения.
В то время, когда экскурсовод ведет свой рассказ, на доске двое учащихся строят строение атомов металлов подгруппы лития. Это задание также повторяет класс.
Вывод: Выяснили строение атомов щелочных металлов, знаем, что они легко отдают электроны, очень химически активны. Помня все это, скажите: встречаются ли щелочные металлы в природе в свободном состоянии или нет?
Ответ класса: Нет, только в виде соединений. Какие вы знаете соединения и где они находятся на территории России (На стене висит географическая карта России). Один из учеников называет основные соединения и показывает их месторождение на карте.
Вопросы:
1. Какое месторождение каменной соли называется "солонкой" в России? Раз щелочных металлов нет в природе в свободном виде, только в виде соединений, то в следующей лаборатории занимаются вопросом получения щелочных металлов, которые нужны для промышленности. Предложите способы получения металлов? Кто желает?
Ответ: Электролизом расплава хлорида натрия расплава щелочи.
У доски и на местах учащиеся одновременно составляют уравнения реакций. Есть ли другие способы?
Есть. Калий можно получать аналогично, но много технических трудностей, поэтому предложили другой способ:
KCl + Na -> K+ NaCl
Р-в пары пары
KOH+Na -> K+NaOH
жидк пары
Теперь перейдем в лабораторию, которая занимается изучением физических свойств.
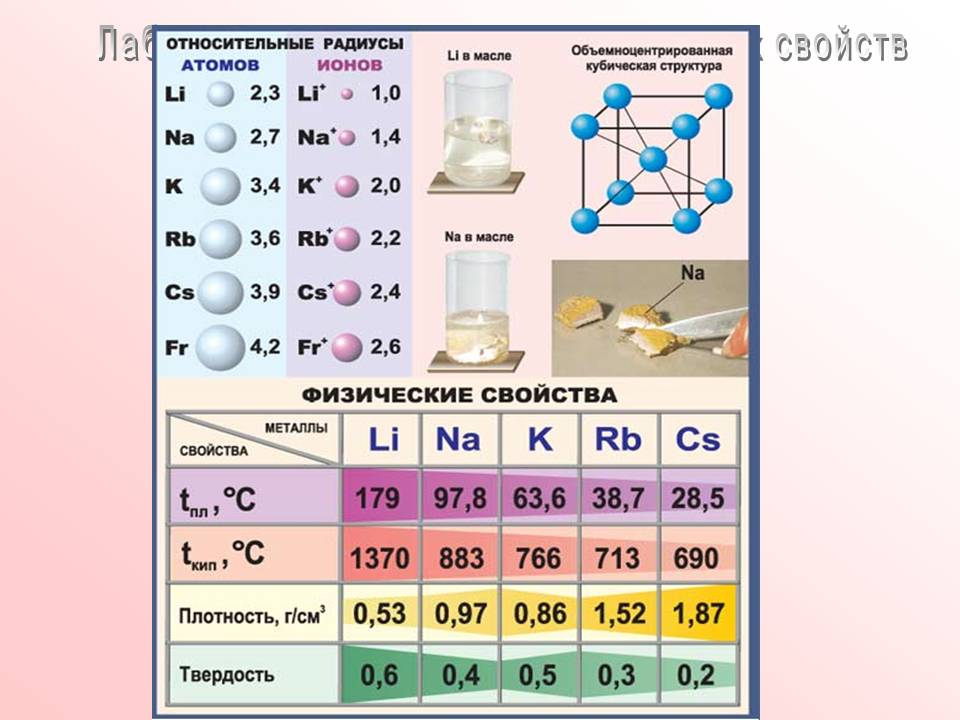
Кто здесь нас ознакомит с работой, которая ведется в данной лаборатории?(рассказ - в атомах щелочных металлов наблюдается металлическая кристаллическая решетка, а значит имеет место металлическая связь.
Строение кристаллической решетки и объясняет свойства щелочных металлов - металлический блеск, серый цвет, пластичность, электро и теплопроводимость и т.д.)
Вопросы:
1. Как изменяется прочность металлической связи от лития к цезию.
2. Какие из щелочных металлов наиболее часто используются.
А теперь перейдем в экспериментальную лабораторию, которая занимается изучением химических свойств металлов. Кто будет экскурсоводом в этой лаборатории?
Строение щелочных металлов нам известно, знаем, что они легко отдают свой электрон, т.е. являются восстановителями, т.е очень химически активные вещества.
Посмотрите, как хранятся щелочные металлы? Под слоем керосина, масла, чтобы не было доступа воздуха. Теперь предположим какие химические свойства характерны щелочным металлам? (учащиеся отвечают на этот вопрос с места, проговаривая уравнения химических свойств).
После выяснения этого вопроса на доску вывешивается заранее приготовленная опорная схема, по которой задаются вопросы классу

Вопросы:
1. Какое общее свойство характерно всем приведенным реакциям?
2. Какое из веществ отдает электроны? Сколько отдается электронов?
3. Что общего и чем отличаются уравнения химических реакций взаимодействия щелочных металлов с водой и с кислотами?
Зная химические свойства щелочных металлов и неорганических соединений, выполним следующие превращения:
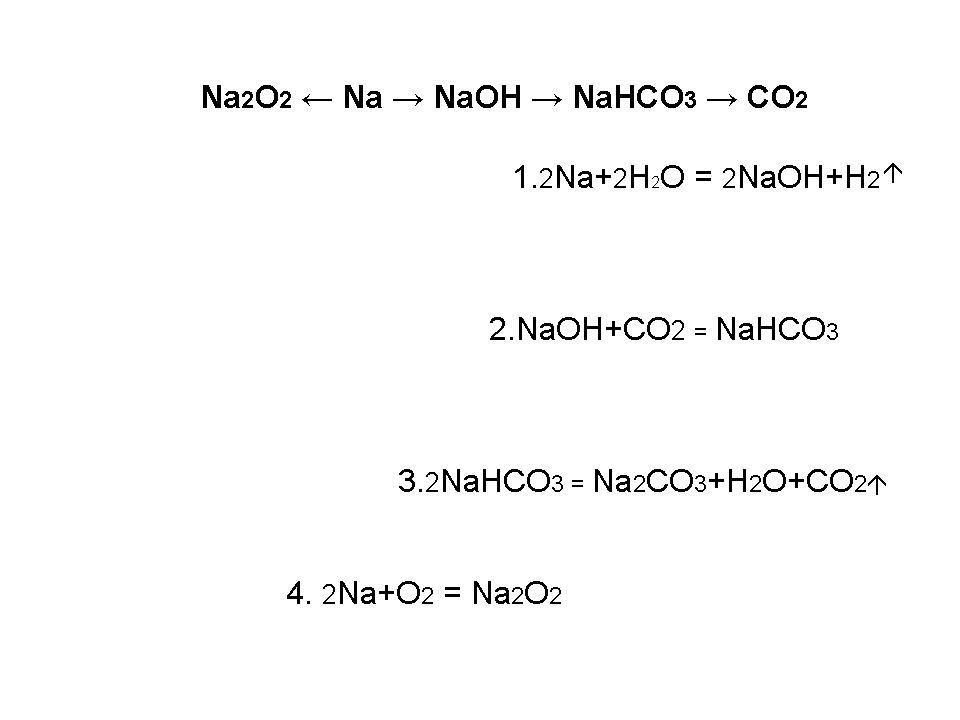
Na2O2 <- Na 0151 -> NaOH -> NaHCO3 -> CO2
(данное превращение имеется в плане урока и лежит на столе у учащихся)
1. 2Na+2H2O=2NaOH+H2
2. NaOH+CО2=NaHCO3
3. 2NaHCO3=Na2CO3+H2O+CO2
4. 2Na + O2 = Na2O2
Это превращение выполняется у доски и на местах.
А в это время ученик - лаборант выполняет опыты, подтверждающие химические свойства щелочных металлов и доказывает, почему металлы так называются.
Опыт № 1 2Na+2H2O=2NaOH+H2 NaОН-щелочь, т.к.фенолфталеин изменяет свою окраску на малиновую.
Опыт № 2 2Na+2HCl=2NaCl+ H2
Опыт № 3
Осталась еще одна лаборатория, в которой занимаются изучением соединений щелочных металлов.
Вопросы:
- Какие вы знаете соединения?
- Каковы их свойства?
Ответ: из периодической системы видно, что щелочные металлы образуют основные оксиды R2O,но начиная с натрия при сгорании в избытке кислорода образуются пероксиды (R2O2).
С водородом при нагревании взаимодействуют щелочные металлы и образуются соединения, которые называются гидриды состава MeH. Щелочные металлы бурно и с выделением большого количества теплоты взаимодействуют с водой, образуя щелочь, состава R-OH и восстанавливая воду до водорода.
Свойства щелочей: диссоциируют, взаимодействуют с кислотными оксидами, с растворами солей. Получают щелочи электролизом раствора солей щелочных металлов.
Составляются уравнения химических реакций на доске и на местах.
Вопрос:
- Как изменяется сила оснований от лития к цезию? (от лития к цезию сила оснований увеличивается т.к. возрастает радиус атома и уменьшается притяжение электронов к ядру).
Заключение.
Вот мы и посетили все лаборатории, за исключением вопроса применения. Эту лабораторию вы посетите самостоятельно и на следующий урок принесете отчет, который будет состоять из рисунка и письменного отчета.
- 1-й ряд - применение солей натрия и калия
- 2-й ряд - применение щелочей
- 3-й ряд - применение щелочных металлов
Задание на дом (в плане урока)
Слово старшему экскурсоводу
Выставление оценок за урок
Подведение итогов.
Некоторым участникам (более сильным) после рассмотрения химических свойств были розданы буклеты с заданиями:
1. Осуществить превращения
Ko - e=K+
K+ + e=Ko
Составить молекулярные уравнения реакций.
2. Осуществить превращения
Na -> NaOH -> Na2CO3 -> CaCO3 -> CaO
3. Закончить уравнения:
Na+H2O=
Li+S=
Li+O2=
NaOH+ H2=
K+Cl2=
Указать переход электронов в окислительно-восстановительных реакциях.