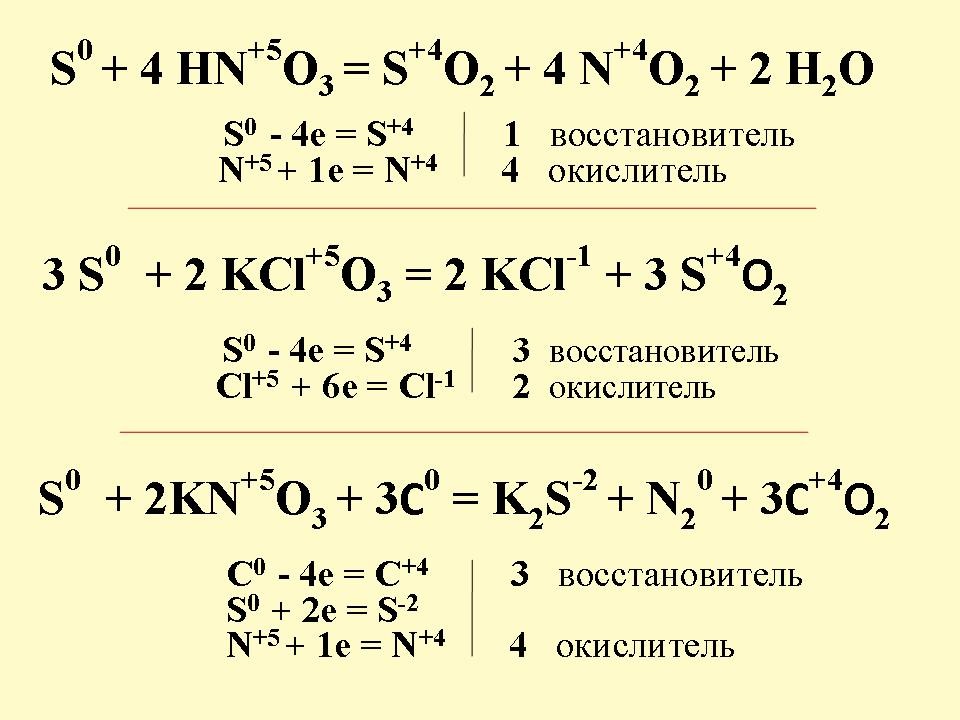Урок изучения нового материала с мультимедийным сопровождением
Цель урока: Сформировать у учащихся основные представления о сере, как о химическом элементе и простом веществе.
Задачи урока:
- Образовательные - рассмотреть положение химического элемента серы в Периодической системе химических элементов Д.И.Менделеева, строение атома. Изучить аллотропные видоизменения и сравнительную характеристику кристаллической и пластической серы. Рассмотреть окислительно-восстановительную двойственность серы. Познакомить учащихся с практическим применением серы. Формировать умения проводить эксперимент.
- Развивающие - развитие умения слушать, формулировать высказывание, анализировать, вырабатывать свою точку зрения и аргументировать свою позицию.
- Воспитательные - воспитывать бережное отношение к окружающей среде, предоставляя сведения о возможном использовании серы вчера, сегодня, завтра. Показать значимость химических знаний для современного человека.
Тип урока: изучение нового материала.
Формы организации познавательной деятельности: фронтальная эвристическая беседа, работа в малых группах (по парам), самостоятельная работа обучающего характера.
Оборудование: экран, компьютер, мультимедийный проектор, компьютерная презентация в программе PowerPoint, коллекция минералов, реактивы: сера, железо, пробирки, штатив для пробирок, шпатель, химический стакан, спиртовка, держатель для пробирок.
Ход и содержание урока
1. Организационный момент
2. Актуализация знаний и мотивация на получение новых знаний
Учитель: Тему сегодняшнего урока вы узнаете, отгадав загадку, представленную на слайде 1: Бедному А совсем неудобно в своей квартире: сверху его грозится сжечь Б, справа – отравить ядовитый Д, а живущий слева тихий Е иногда начинает буянить и уж совсем не ясно чего от него ждать – либо отравит, либо подожжёт квартиру (он ведь входит в состав спичек). Но когда Е успокаивается, то начинает светиться бледно-зеленым светом и всех этим радует. Кто такой А и кто его соседи [2]?
Учащиеся: А – это сера, Б – кислород, Д – хлор, Е – фосфор.
Учитель: Вы правы – это сера. Как вы догадались?
Учащиеся: По свойствам, а также по положению химических элементов в Периодической системе Д.И.Менделеева. Нам известно, что кислород газ, поддерживающий горение. Химический элемент кислород в Периодической системе находится над серой. Справа по группе с серой расположен хлор. Хлор является токсичным удушливым веществом, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Слева по группе расположен фосфор, входящий в состав спичек и способный к свечению.
Учитель: Сегодня нам предстоит знакомство со свойствами химического элемента и вещества серы (слайд 2).
3. Изучение нового материала
Открытие серы (учащийся выступает с сообщением об истории открытия серы)
Характеристика химического элемента (слайд 3)
Учитель предлагает учащимся охарактеризовать положение серы в Периодической системе (порядковый номер, номер периода, группы, подгруппа, относительная атомная масса) и рассмотреть строение атома (заряд ядра, количество протонов, нейтронов, электронов, строение электронной оболочки).
Учитель: На основе строения атома, предположите возможные степени окисления серы и сделайте выводы об основных свойствах серы (ответы учащихся).
Нахождение серы в природе (слайд 4)
Сера широко распространена в природе: массовая доля этого элемента в земной коре составляет 0,05%. Встречается сера в свободном (самородном) состоянии и связанном виде: сульфатном и сульфидном.
По мере объяснения материала появляются картинки слайда, и учитель рассказывает о важнейших природных соединениях серы, а также об использовании этих минералов человеком. Например: формула киновари HgS. Киноварь с древности применялась в качестве красной краски, как источник для получения ртути.
Пиритовые руды (пирит FeS2, халькопирит FeCuS2) являются одним из основных видов сырья, используемого для получения серной кислоты.
Физические свойства – учащиеся знакомятся с физическими свойствами простого вещества – серы, выполняя лабораторный опыт.
Лабораторный опыт 1. Рассмотрите образец серы, определите:
- агрегатное состояние при н.у.
- цвет.
- растворимость в воде.
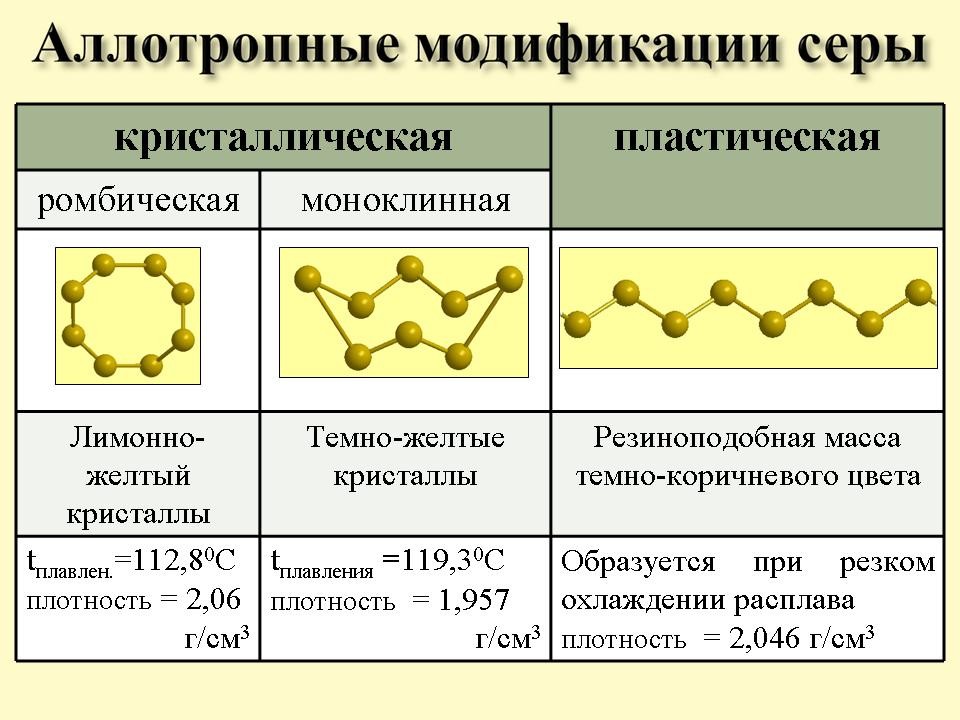
Вывод: Сера - это твердое вещество, желтого цвета, нерастворимая в воде.
Учитель: На слайде 5 мы видим, что сера существует в трёх аллотропных модификациях. А что такое аллотропия? Какие ещё вы знаете элементы, образующие аллотропные модификации?
Учащиеся: Аллотропия – свойство химического элемента образовывать несколько простых веществ. Кислород имеет две аллотропные модификации: кислород (О2) и озон (О3); углерод – алмаз и графит.
Учитель демонстрирует получение пластической серы из ромбической.
Химические свойства серы (слайды 6-10)
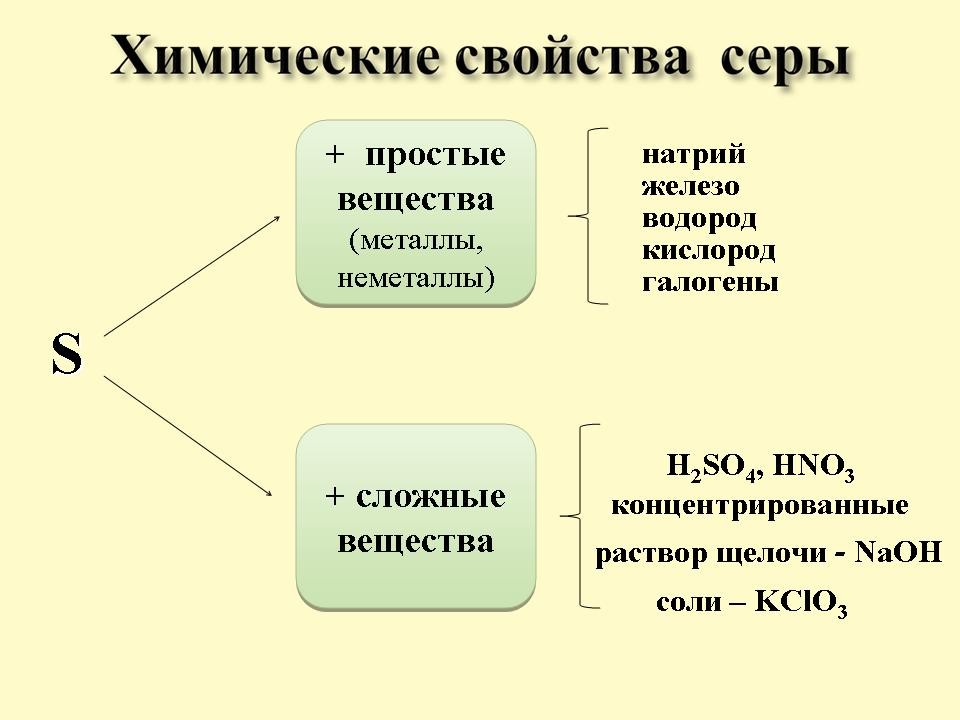
Учитель: Ребята, а как вы думаете, с какими веществами реагирует сера?
Учащиеся: С металлами, неметаллами, возможно со сложными веществами.
Учитель: Какими свойствами - окислительными или восстановительными обладает сера? (учащиеся выдвигают гипотезы)
А) Сера при обычных условиях реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром (слайд 7).
- S0 + 2 Na0 = Na+12 S-2
- S0 + 2 e =
 1 окислитель
1 окислитель - Na0 – 1 e = Na+1 2 восстановитель
- S + Hg = HgS
Ребята, а где может использоваться данная реакция? Вспомните, какими свойствами обладает ртуть (ответы учащихся).
Учитель: Итак, ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Капельки ртути, видимые глазом, можно собрать на лист бумаги. Места, из которых ее нельзя извлечь, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество.
При нагревании сера реагирует с другими металлами, например с железом. Демонстрационный эксперимент. Взаимодействие железа и серы.
(Рассмотреть дома реакции взаимодействия серы с железом и ртутью, как окислительно-восстановительные)
Б) Взаимодействие с неметаллами (слайд 8).
Учащиеся самостоятельно записывают уравнения реакции серы с водородом и кислородом, составляют окислительно – восстановительные схемы. Затем идет проверка выполненного задания.
В) Взаимодействие со сложными веществами (слайд 9, 10)
Самостоятельная работа – учащиеся по вариантам составляют электронный баланс и расставляют коэффициенты в уравнениях реакций:
- 1 вариант – взаимодействие серы с концентрированной азотной кислотой
- 2 вариант – взаимодействие серы с бертолетовой солью (хлоратом калия)
- 3 вариант – взаимодействие серы с углем и нитратом калия
Далее идет взаимопроверка выполненного задания по слайду 10. Учитель рассказывает о применении данных химических реакций: реакция взаимодействия нитрата калия (калийной селитры), серы и древесного угля лежит в основе получения дымного пороха, который в настоящее время используется в фейерверках.
Взаимодействие серы с бертолетовой солью лежит в основе “работы” спичек. Смесь красного фосфора и сульфида сурьмы (III) Sb2S3 с помощью клея наносят на боковую поверхность спичечного коробка. Головку спички готовят из бертолетовой соли, серы, стеклянного порошка и клея. Под действием трения красный фосфор загорается благодаря кислороду бертолетовой соли. Он и поджигает головку спички. В ней вспыхивает сера или сульфид сурьмы (III). А затем уже загорается дерево.
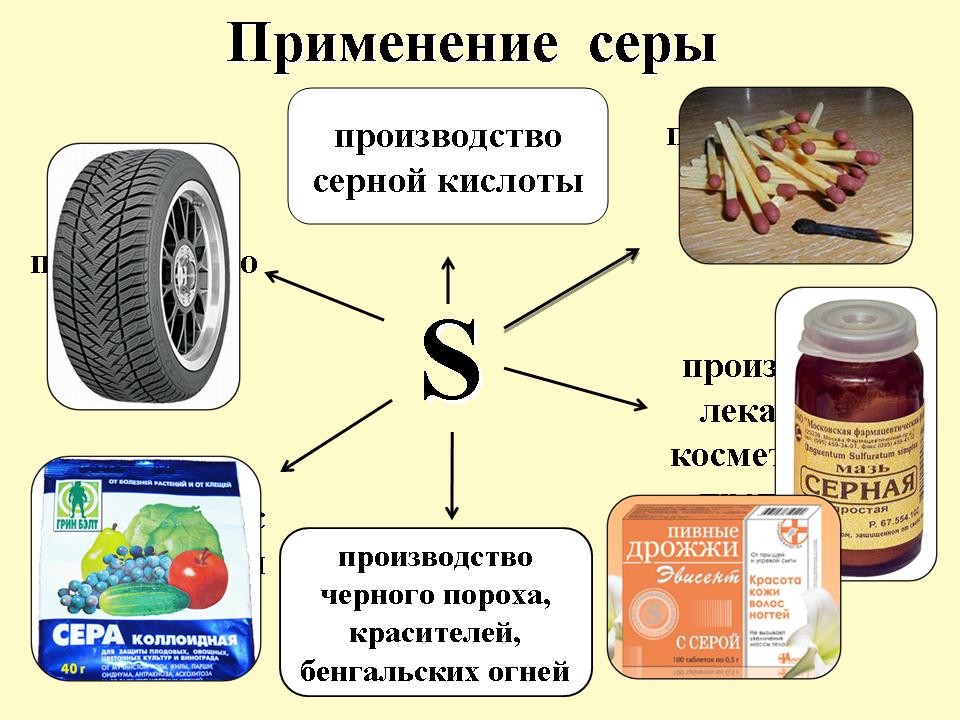
Применение серы (слайд 11)
Среди вещей, окружающих человека, много таких, для изготовления которых нужны сера и ее соединения. Ткани и лекарства, косметика и пластмассы, бумага и резина, эбонит и спички, порох и краска – вот не полный перечень вещей и веществ, для производства которых нужна сера. Для того чтобы изготовить, например, автомобиль, требуется израсходовать около 14 кг серы.
Главный потребитель серы – химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H2SО4, нужно сжечь около 300 кг серы.
Сера применяется и в сельском хозяйстве в качестве минеральных удобрений и препаратов для борьбы с вредителями.
Один из учащихся на доске решает задачу: Для освобождения зернохранилищ от вредителей зерна может быть использован сернистый газ SO2, для чего необходимо, чтобы в каждом кубометре помещения содержалось не менее 50 г SO2.
Какую массу серы потребуется сжечь в хранилище высотой 10 м и площадью 900 м2, чтобы полностью избавить помещение от вредителей?
| Дано: | Решение: |
| m (SO2) = 50 г | 1. Вычислим объём зернохранилища: V = h*S |
| h (хранилища) =10 м | V (хранилища) = 10 * 900 = 9000 (м3) |
| S (хранилища) =900 м2 | 2. Необходимая масса SO2 составляет: |
| m (SO2) = 50 * 9000 = 450000 | |
| Найти: | 3. х г 450000 г |
| m (S) -? | S + O2 = SO2 |
| 1 моль 1 моль | |
| 32 г/моль 64 г/моль | |
| 32 г 64 г | |
| m (S) = 225000 (г) или 225 кг | |
| Ответ: масса серы = 225 кг |
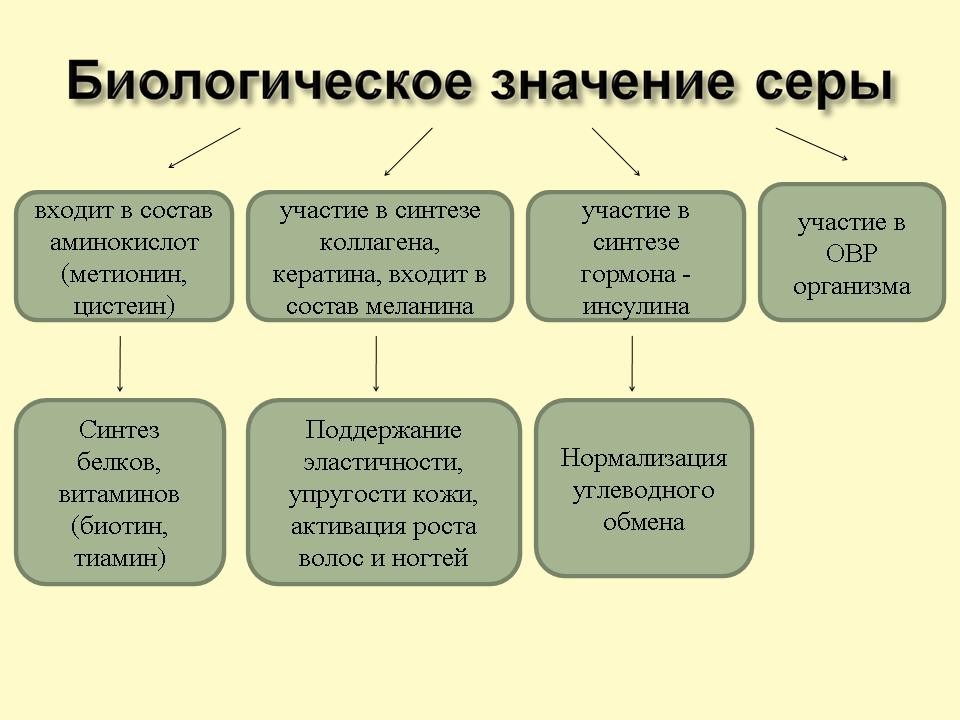
Биологическое значение серы (слайд 12)
Учитель: Сера – жизненно важный элемент. Она входит в состав белков. Особенно много серы в белках волос, шерсти, ногтей (входит в состав коллагена, кератина и меланина). Является составной частью биологически активных веществ организма: витаминов и гормонов (инсулин).
Сера участвует в окислительно-восстановительных процессах организма. При её недостатке в организме наблюдается хрупкость и ломкость костей, выпадение волос. Она улучшает работу нервной системы; повышает иммунитет; оказывает противоаллергическое воздействие; укрепляет мышечную ткань (особенно в период активного роста у детей и подростков)
4. Рефлексия
Учитель: В завершение давайте проведем творческую работу: составьте синквейн по теме урока.
Пример синквейна, выполненного учащимися:
Сера
- Желтая, кристаллическая
- Дезинфицирует, горит, структурирует
- Сера является представителем халькогенов
- Макроэлемент
5. Подведение итогов урока.
Комментированное выставление оценок.
Домашнее задание: параграф 22, выполните упражнения 1, 2 на странице 49.
Список литературы.
- Габриелян О.С. Химия. 9 класс. - М.: Дрофа, 2008. С 45-49.
- Занимательные задачи по химии / Под ред. Н.Е.Дерябиной. – М.: ИПО “У Никитских ворот”, 2010. С 36.
- Хомченко И.Г. Общая химия: Учебник. – М.: РИА “Новая волна”: Издатель Умеренков, 2010. С 123-125.
- http://ru.wikipedia.org/wiki/Киноварь
- http://ru.wikipedia.org/wiki/Галенит
- http://ru.wikipedia.org/wiki/Sulphur
- http://ru.wikipedia.org/wiki/Гипс
- http://www.librarhy.ru/Elements/sulfur.html
- http://www.floriculture.ru/rast/yhod/care/sera_kolloidnaya.shtml
- http://www.foxsaver.com/public/picture/270145281
- http://hnb.com.ua/articles/s-zdorovie-sera_s-344
- http://n-t.ru/ri/ps/pb016.htm