| Цель урока: | подвести обучающихся к пониманию строения атомной системы через анализ фундаментальных исторических опытов. |
| Задачи урока: | познакомить обучающихся с историей
развития взглядов на строение атома; рассказать о проведении опыта Резерфорда; показать роль крупных ученых в развитии науки; продолжить формирование навыков критического мышления через организацию учебного диалога и применение знаний классической физики в новой ситуации. |
| Учебно-методическое обеспечение: | Перышкин, А. В. Физика. 9 кл. [Текст] : учеб. для общеобразоват. учебн. заведений / А. В. Перышкин, Е. М. Гутник. – М. : Дрофа, 2010. – 255 с. |
| Время реализации урока: | 45 минут. |
| Авторский медиапродукт: | Наглядная презентация учебного материала “Строение атома”, выполненная в программе MS PowerPoint 2010, содержит 29 слайдов (включая титульный слайд). |
| Демонстрации: | Анимация со звуком “Опыт Резерфорда”. Видеоролик-анимация “Планетарная модель атома”. |
| Оборудование: | компьютер, проектор, экран. |
| План изложения нового материала | Опыт Эрнеста Резерфорда. Модель строения атома. Элементарный состав атома. Характеристика частиц, входящих в состав атома. Фундаментальные законы микромира. |
| Технология | развития критического мышления. |
I. Организационный момент (2 мин.)
- Определение отсутствующих обучающихся.
- Указание на продолжение изучения главы “Строение атома и атомного ядра. Использование энергии атомных ядер”.
II. Проверка знаний (8 мин.)
Стадия вызова
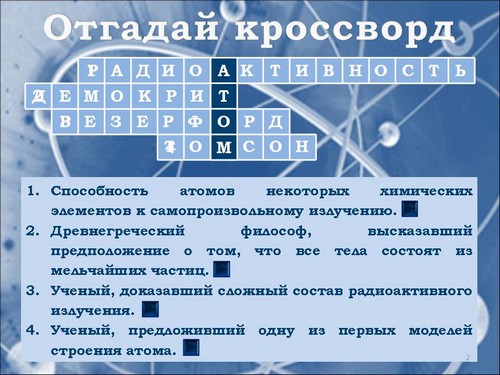
Отгадывание кроссворда (Слайд 2):

- Способность атомов некоторых химических элементов к самопроизвольному излучению (радиоактивность).
- Древнегреческий философ, высказавший предположение о том, что все тела состоят из мельчайших частиц (Демокрит).
- Ученый, доказавший сложный состав радиоактивного излучения (Резерфорд).
- Ученый, предложивший одну из первых моделей строения атома (Томсон).
На слайд выведены все вопросы, отвечать на которые можно в любом порядке. Для проверки правильности ответа, необходимо нажать на цифру вопроса, после чего номер вопроса исчезнет, а появится правильный ответ. Проверку знаний можно расширить, если воспользоваться кнопкой перехода по гиперссылке на соответствующий слайд, поставленной на каждый вопрос. Вернуться на слайд кроссворда можно с помощью управляющей кнопки. После разгадывания кроссворда, по вертикали можно прочитать слово “атом”, чтобы это было явно, необходимо нажать на любое место в столбце, он закрасится более темным цветом.

III. Изложение нового материала (20 мин.)
Конец XIX века. Открыты катодные лучи, термоэлектронная эмиссия, фотоэффект, анодные лучи, явление естественной радиоактивности, периодические свойства химических элементов, электрон, измерены его заряд и масса, создана периодическая система элементов – все это указывало на сложное строение атома. Назрела необходимость создания модели атома. Мы знаем, что мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 году, развил Х. Лоренц (именно он создал электронную теорию: электроны входят в состав атома). Опираясь на эти открытия, Дж.Томсон предложил первую модель атома в виде положительно заряженного шара радиусом 10-10 м, в котором плавают электроны, нейтрализующие положительный заряд, но размер атома необходимо было уточнить. Как это было сделано, и какой результат был получен, мы узнаем на уроке.
Озвучивание спектра вопросов, которые будут рассмотрены в ходе урока (Слайд 3):
- Опыт Эрнеста Резерфорда
- Модель строения атома
- Элементарный состав атома
- Характеристика частиц, входящих в состав атома
- Фундаментальные законы микромира
Стадия осмысления
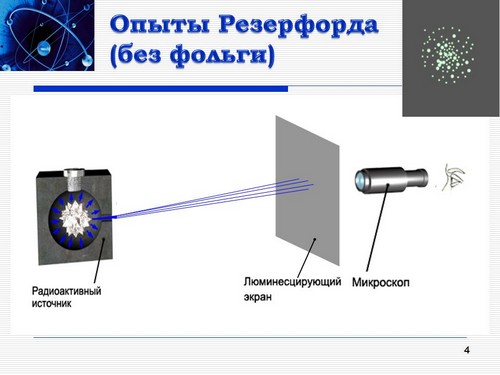
1. Опыты Резерфорда. Планетарная модель атома. Экспериментальная проверка модели Томсона была осуществлена в 1911 году английским физиком Э.Резерфордом (Слайд 4). Узкий пучок быстрых a-частиц пропускался через очень тонкую металлическую пленку, затем попадал на экран из сернистого цинка, вызывая при этом вспышку света, и регистрировался с помощью микроскопа. Видно, что в отсутствии фольги все сцинтилляции располагаются в центре экрана.
Возникает вопрос (Пробуждение познавательной активности путем вовлечения учащихся в деятельность по формулировке гипотез):
Каков вид фотографии экрана будет, если на пути пучка a-частиц поместить фольгу?
Выдвигаемые обучающимися гипотезы (Самостоятельное выдвижение гипотезы):
Вид фотографии экрана не изменится, т.к. энергия a-частицы очень большая, а атом – рыхлое нейтральное образование.
Пучок a-частиц при прохождении через тонкую фольгу слегка расплывется на небольшие углы. Следовательно, на фотографии площадь экрана, на которую попадают частицы, слегка увеличится.
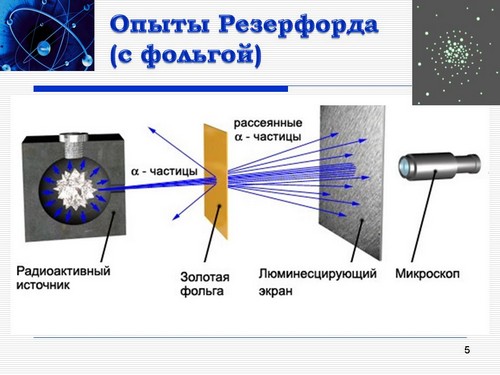
Проверим наши гипотезы (Проверка выдвинутых гипотез), анимация со звуком “Опыт Резерфорда” позволит представить процесс в 3D-формате (видеофрагмент включается с помощью гиперссылки, поставленной на фотографию экрана).
Ни одна из гипотез не подтвердилась. (Слайд 5). Пропуская пучок a-частиц (заряд +2е, масса 6,64 * 10-27 кг) через тонкую золотую фольгу, Резерфорд обнаружил, что часть частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть a-частиц (примерно одна из 20 000) отражается от фольги толщиной всего лишь 4 * 10-5 см.
Получается: модель атома Томсона с одной стороны хорошо объясняет электризацию тел, с другой – не подтвердилась на опыте Резерфорда (Создание “информационной пустоты”).
Для того, чтобы предложить новую модель атома, на какие вопросы необходимо было найти решение:
Предлагаемые обучающимися вопросы (Самостоятельное определение учащимися направлений в изучении темы):
- Как можно объяснить результаты опыта?
- Как должны располагаться заряды в атоме?
Высказанные обучающимися предположения:
В атоме положительный заряд должен занимать маленький объем, чтобы при взаимодействии с a-частицей ее оттолкнуть с большой силой.
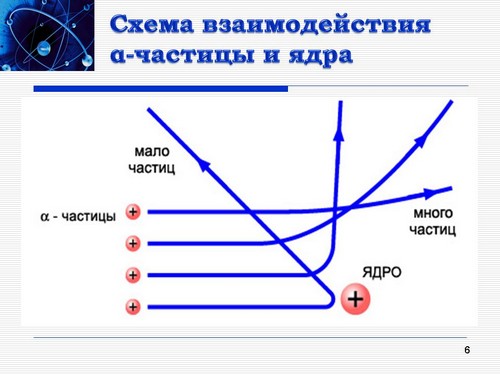
2. Модель строения атома (Организация активной работы с информацией). Действительно, обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома: Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома. В ядре сконцентрирована почти вся масса атома. Отрицательный заряд всех электронов распределен по всему объему атома (Слайд 6). По гиперссылке, поставленной на рисунок, поясняющий процесс прохождения a-частицы сквозь атомы вещества, можно посмотреть видеоролик - анимацию со звуком "Планетарная модель атома".
Таким образом, модель атома Томсона заменена на модель атома Резерфорда (Слайд 7). По гиперссылке, поставленной на подписи моделей можно перейти на слайды Томсон Джозеф Джон и Эрнест Резерфорд (Слайды 21 и 22) для знакомства с научными достижениями ученых.
Возникают вопросы:
- Из каких частиц состоит ядро атома?
- Как определить количественный и качественный состав ядра?
3. Элементарный состав атома. Ядро состоит из нейтронов и протонов, их общее название – нуклоны. Количество нуклонов характеризуется массовым (оно равно массе ядра атома, выраженной в атомных единицах и округленной до целых чисел) и зарядовым (число протонов в ядре называется зарядовым числом, оно равно порядковому номеру в Периодической системе Д. И. Менделеева) числам. (Слайд 8). По управляющим кнопкам можно перейти на слайды 23 и 24, где решены задачи на определение этих массового и зарядового чисел для атомов золота и серебра.
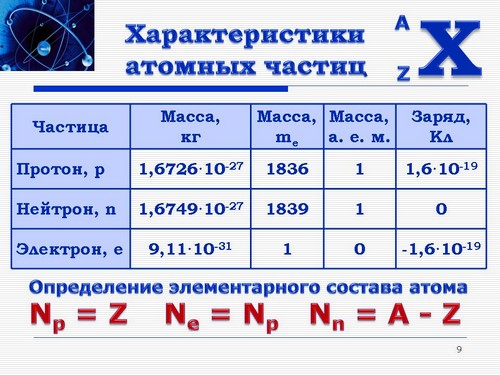
4. Характеристика частиц, входящих в состав атома. Такое простое нахождение количественного состава нуклонов объясняется их характеристиками (Слайд 9).
| Частица | Масса, кг |
Масса, me | Масса, а. е. м. |
Заряд, Кл |
| Протон, p | 1,6726*10-27 | 1836 | 1 | 1,6*10-19 |
| Нейтрон, n | 1,6749*10-27 | 1839 | 1 | 0 |
| Электрон, e | 9,11*10-31 | 1 | 0 | -1,6*10-19 |
5. Фундаментальные законы микромира. При написании ядерной реакции а-распада ядра атома радия с превращением его в ядро атома радона (в ходе написания реакции обучающиеся определяют массовое и зарядовое число каждого элемента) наблюдается интересная закономерность, попробуйте ее найти (Слайд 10).
Обучающиеся замечают, что массовое и зарядовое числа ядра атома радия равны сумме массовых и зарядовых чисел ядер атомов радона и гелия, образовавшихся в результате этого распада.
Стадия рефлексии
Закрепление изученного материала (12 мин.)
1. Обучающимся предлагается составить синквейн по теме урока по плану (Слайд 11):
- 1 строка – тема или предмет (одно существительное);
- 2 строка – описание предмета (два прилагательных);
- 3 строка – описание действия (три глагола);
- 4 строка – фраза из четырех слов, выражающая отношение к предмету;
- 5 строка – синоним, обобщающий или расширяющий смысл темы или предмета (одно слово).
(Самостоятельная систематизация материала).
Атом
Нейтральный, устойчивый.
Существует, излучает, распадается.
Составная часть любого тела.
Начало.
2. Решить задачи (текст задачи и варианты ответа на слайде приведен сразу, по щелчку мыши указывается номер правильного ответа (Слайды 12 – 19))
V. Домашнее задание (3 мин.):
- Параграф 66, 67.
- Выполнить (по желанию) творческое задание по
теме “Строение атома” :
- Составить кроссворд;
- Сочинить синквейн по плану.
Электронные адреса использованных Интернет-ресурсов:
- Анимация со звуком “Опыт Резерфорда”:
- http://files.school-collection.edu.ru/dlrstore/85a43aa4-1f7a-455a-ac5a-e1a58587a7ef/9_250.swf
- Видеоролик - анимация "Планетарная модель атома":
- http://school-collection.edu.ru/catalog/res/8339c48d-4ba1-4e1e-8ae5-a416bc6bc99d/?from=8b74c9c3-9aad-4ae4-abf9-e8229c87b786&interface=pupil&class=51&subject=30