Тип урока. Урок изучения нового материала с элементами проверки знаний, с использованием цифровых образовательных ресурсов.
Цель урока. Доказать делимость атома на основе изучения научных данных, подтверждающих сложность строения атома и атомного ядра.
Задачи урока:
- Проверить знания учащихся по теме: “Химические формулы”.
- Показать взаимосвязь понятий: протон, нейтрон, массовое число.
- Развивать умение сопоставлять новые научные данные с уже известной структурой Периодической системы.
Оборудование:
- Цифровой образовательный ресурс (электронный учебник “Неорганическая химия”) МарГТУ, 2008г. Лаборатория мультимедиа. Ресурс размещен по адресу: eor. edu. ru.
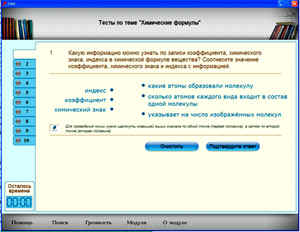
- модуль № 065 Тест: “Химические формулы”;
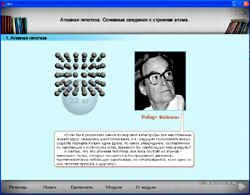
- модуль № 107 “Атомная гипотеза. Основные сведения о строении атомов”;
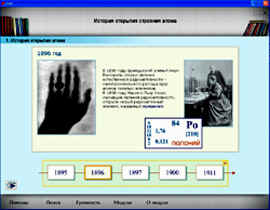
- модуль № 108 “История открытия строения атома”;
- модуль № 111 “Опыт Резерфорда”.
- Периодическая система химических элементов Д. И. Менделеева.
- Плакат из курса физики “Строение атома”. Модели атомов некоторых элементов.
Новые понятия.
- Элементарные частицы
- Нуклоны
- Массовое число
- Электрон
- Протон
- Нейтрон
- Электронная оболочка
- Электронное облако
- Изотопы
- Электронные уровни
Приложение 1
Приложение 2
Приложение 3
Приложение 4
План урока
I. Организационный момент: проверка наличия принадлежностей к уроку, наличие листочков для ответов на вопросы теста, Периодическая система химических элементов (на каждом столе).
| Деятельность учителя | Деятельность учащихся | Использование электронного учебника | ||||||||||||||||||||||||||||||||||
II. Проверочная работа (10 минут). Тест “Химические формулы”. Вопросы теста подаются на экран. Приложение 1.
III. Формирование новых понятий.
1. Важнейшие этапы истории развития представлений о строении вещества.
Приложение 2.
Приложение 3.
Вывод: В начале ХХ века разрушилось представление о неделимости атома. Причиной послужили открытие электронов, явление радиоактивности. Атом – сложная частица.2. Планетарная модель атома (Резерфорд). Приложение 4.
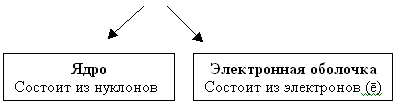
На основании опытов Резерфорда было установлено: (составляется схема на доске)
Атом
“Нуклеус” (латинское nucleus) – ядро. Масса атома сосредоточена в ядре. Поэтому эта модель называется – нуклеарная. Характеристики элементарных частиц. Таблица 2 в учебнике.
IV. Выводы по уроку.
V. Применение знаний. Определите число протонов, электронов, нейтронов для атомов элементов.
VI. Домашнее задание. § 6. Упр. 4,
5. Рассмотреть строение атомов: Fe, B, Ag. |
Отвечают на листочках.
Слушают пояснения к слайдам.
Записывают тезисами в тетрадь.
Вспоминают сведения из курса физики. Обращаются к учебнику, рассматривают рисунок 6
“Радиоактивное излучение в электрическом
поле”.
Рисуют схему в тетрадях
Записывают в тетрадях.
Изучают таблицу 2 в учебнике. Выписывают из таблицы примечания.
Записывают в тетрадях.
Выполняют в тетрадях. Проверяем фронтально.
Записывают домашнее задание. |
Электронный учебник модуль
№ 065. Тест “Химические формулы”
Работа с электронным учебником. Модуль № 107 “Атомная гипотеза. Основные сведения о строении атома”.
Работа с электронным учебником. Модуль № 108 “История открытия строения атома”.
Работа с электронным учебником. Mодуль № 111 “Опыт Резерфорда”.
|
В работе используется цифровой образовательный ресурс (электронный учебник “Неорганическая химия”) разработанный лабораторией мультимедиа Марийского Государственного Технического Университета в 2007 – 2008 году по заказу Федерального агентства по образованию РФ.
Ресурс размещен по адресу: eor. edu. ru.