Введение
Курс естествознания среди базовых общеобразовательных курсов обусловлен ведущей ролью естественных наук в познании природы, развитии техники и современных технологий, изменения условий жизни, повышения требований к качеству уровня общественных взаимоотношений. Естественнонаучный метод познания способствует развитию критического мышления, формированию культуры общения, развивает умения вести дискуссии, ответственно аргументировать, стремление совершенствовать свои умственные способности применять их в жизни – это те качества человека, которые необходимы каждому в современном обществе. Изучение естествознания поможет учащимся степени среднего (полного) общего образования на базовом уровне получить знания о современной естественнонаучной картине мира, познакомит с наиболее важными идеями, теориями и достижениями наук, поможет сформировать информацию, содержащуюся в СМИ, Интернете, научно-популярной литературе. Немаловажную роль естествознание оказывает на формирование осознанного определения собственной позиции по отношению к проблемам общества, развития наук, использования полученных знаний для обеспечения безопасности своей жизнедеятельности, здоровья, предотвращения опасных экологических и нравственных последствий, связанных с достижениями науки.
Одной из важнейших тем курса, предусмотренных Примерной программой среднего (полного) общего образования по естествознанию является: “Химическое вещество” и “Химическая реакция”, на которую отводится 16 часов.
В своей работе я представляю методическую разработку урока: “Скорость реакции и факторы, влияющие на нее”.
Также я предлагаю дидактический материал к уроку, демонстрационный эксперимент и лабораторный практикум по этой теме, использование групповой работы учащихся. Это обеспечивает более высокий уровень результативности и продуктивности учебной работы:
- повышается уровень осмысления материала,
- увеличивается уровень качества реализации интеллектуальных возможностей каждого учащегося, растет число нестандартных решений,
- осуществляется перенос знаний и умений,
- формируется позитивное отношение к изучаемому материалу, более дружественная обстановка в коллективе, повышается самооценка школьников, уровень их самостоятельности в овладении знаниями и умениями.
Тема урока: “Скорость химической реакции и факторы, влияющие на нее”
Цель урока: Систематизировать и улучшить знания учащихся о скорости химической реакции. Дать понятие скорости для гомогенной и гетерогенной реакции. Продолжить формирование знаний о факторах, влияющих на скорость реакции, умение объяснять действия каждого фактора на примерах. Развивать умения работать в группе. Стимулировать познавательную активность учащихся путем создания проблемной ситуации и проведения ими химического эксперимента. Развивать умения анализировать, обобщать, выделять главное, составлять схемы, таблицы, делать предположения и выводы.
Оборудование: реактивы и химическая посуда для демонстрационного опыта и лабораторного эксперимента “Факторы, влияющие на скорость химической реакции.
Учебно-наглядные пособия: “Скорость химической реакции”, “Механизм действия катализатора”, “Разложение пероксида водорода в присутствии оксида марганца” (или провести опыт), дидактический материал по теме урока.
I. Подготовка к восприятию нового материала.
Работа классу: Задание:
Разберите каждую с точки зрения разных классификаций, запишите, если можно, в окислительно-восстановительном виде или в ионном виде. Вспомните определение данных типов реакций.
Работа по вариантам:
1 В.
А) Реакция взаимодействия сульфата меди (2) и
железа.
Б) Разложение гидроксида меди (2)
2 В.
А) Реакция взаимодействия растворов хлорида
железа и гидроксида калия.
Б) Этилена с водородом.
Аналогичные задания получают 2 учащихся, вызванных к доске и выполняют, таким образом на специальных досках, чтобы в классе их решения могли сравнить со своим по окончании взаимопроверки.
Затем учитель демонстрирует реакции а) из каждого задания и просит ответить на вопросы: Какие признаки реакций мы наблюдаем при их проведении? Почему признаки реакции а) из 1 варианта наблюдаются не сразу?
Учащиеся отвечают на вопросы, делают свои предположения и учитель подводит итог: все дело в том, что при данных условиях эти две реакции протекают с разной скоростью.
Учитель сообщает тему урока, учащиеся записывают ее. Вместе с учителем формулируют цель урока: систематизировать и углубить свои знания о скорости химической реакции и факторов, влияющих на нее.
Вначале обсуждаем значение знаний вопроса о скорости химической реакции для организмов, производства, окружающей нас среды.
Затем учитель, используя график зависимости концентрации исходного вещества от времени, еще раз формулирует понятие “скорость реакции”, записывает формулу для гомогенной реакции, определяя единицы измерения скорости:
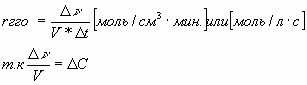 , то
следовательно
, то
следовательно
![]()
Определение: скорость химической реакции показывает изменения количества реагирующего вещества в единицу времени в единице объема. Из определения следует обратить внимание на прямую зависимость скорости гомогенной реакции от концентрации реагирующего вещества и сформулировать закон действия масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции:
A+B![]() C
C
r=![]()
Далее следует обратить внимание, что для гетерогенных реакций надо учитывать площадь поверхности твердого реагирующего вещества, как в случае реакции взаимодействия сульфата меди (2) и железа, после этого дать формулу вычисления скорости гетерогенных реакций:
![]()
После этого начинается работа в группах по выяснению факторов, влияющих на скорость реакции. Каждая группа получает инструкцию, предварительно еще раз обсуждается необходимость соблюдения правил по технике безопасности при работе с реактивами, стеклянными и нагревательными приборами.
В течение 5–7 минут каждая группа проводит эксперимент, описывает полученные результаты, делает выводы.
1 группа рассматривает зависимость скорости реакции от природы реагирующих веществ на примерах взаимодействия Zn, Fe, Cu с соляной кислотой при обычных условиях.
2 группа рассматривает зависимость скорости от поверхности соприкосновения реагирующих веществ на примере взаимодействия кусочка мела и порошка с соляной кислотой.
3 группа рассматривает зависимость скорости реакции от концентрации веществ на примере взаимодействия железа с 10% и 30%-ной соляной кислотой.
4 группа рассматривает зависимость скорости реакции от температуры на примере взаимодействия оксида меди (2) без нагревания с серной кислотой и при нагревании.
По истечению отведенного времени представители групп рассказывают о проделанной работе. Результаты заносятся всеми в таблицу. При необходимости учитель делает дополнения, поясняет правило Вант-Гоффа.
Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов – скорость реакции увеличивается в 2 – 4 раза.
Это может быть выражено математически:
![]()
Расшифровка:
Скорость при увеличенной температуре равна произведению скорости при начальной температуре температурного коэффициента.
При этом необходимо ввести понятия энергетического барьера. Для этого учитель использует график, показывающий изменения энергии в ходе реакции, а также схему распределения, например, молекул газа по энергии при различных температурах, при которых видно, что чем выше температура, тем больше молекул, которые способны перенести энергетический барьер, т.е. тем больше молекул, обладающих достаточно большой энергией так называемых активных молекул, тем самым увеличивается и скорость химической реакции. С зависимостью скорости реакции от наличия катализатора учитель показывает по видео фрагменту: “Разложение пероксида водорода в присутствии оксида марганца (4)” или, показав сам опыт. Затем учитель вместе с учащимися разбирает механизм действия катализатора: роль катализатора состоит в образовании промежуточных соединений с меньшей затратой энергии, чем без них.
A+K![]() AK
AK
Промежуточное соединение:
AK+B![]() AB+K
AB+K
K – катализатор.
Затем учитель подводит итог урока и проводит закрепление темы в форме беседы по вопросам:
- Что показывает скорость химической реакции
- От каких факторов зависит скорость химической реакции
- С какими из металлов – калием, медью, оловом, железом – соляная кислота реагирует с наибольшей скоростью
- Запишите выражение закона действия масс для реакций: 2А+В=С
- Как изменится скорость реакции если увеличить концентрацию веществ А и В в 2 раза в предыдущем задании.
- Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 150 до 200 градусов, если температурный коэффициент равен трем.
(Ответ: в 243 раза)
Вопросы должны быть заранее составлены и записаны на доске.
Или закрепление можно провести с помощью небольшой самостоятельной работы по тестам, результаты которой обсудить при подведении итогов с заранее подготовленными ответами на экране или доске.
1) В наибольшей скоростью при обычных условиях протекает реакция:
1. 2Са+О2=2СаО
2.Са2++СО2-3=СаСО3
3.СА+2Н+=Са2++Н2![]()
4. Са+S=CaS
2) Для увеличения скорости реакции
2СО+О2=2СО2+Q
Необходимо:
- Увеличить концентрацию СО.
- Уменьшить концентрацию О2.
- Понизить давление
- Понизить температуру
3) Закон действия масс записан правильно для реакции 2А+3В = С.
В случае:
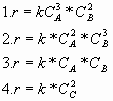
4) Выражение для скорости гомогенной реакции записано верно в случае:
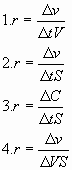
5) Выражение для скорости гетерогенной реакции записано верно:
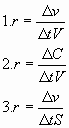
6) Математическое выражение правила Вант-Гоффа, если t1=100, t2=200, k=3
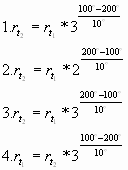
После проверки заданий по закреплению и оценки работы учащихся учитель поясняет домашнее задание:
Параграфы и задания по учебникам (в зависимости от наличия в школе)
- Л. С. Гузей, Р. П. Суровцева Химия (10 класс). § 24.7 упр.2, 8, 16. § 24.8 упр. 2,4, 5, 6.
- Фельдман, Рудзитис. Химия (11-й класс). § 2 стр. 89-90, упр. 6, 7. О.С.
- Габриелян. Химия 11 класс. § 13 упр. 6, 8, 9,10.
А также можно предложить учащимся подготовить сообщение о роли катализаторов в процессах жизнедеятельности организмов.