Цель урока: формирование химических компетенций учащихся посредством применения информационно-коммуникационных технологий.
- Образовательный аспект: изучение основных соединений кальция, их значения для жизнедеятельности человека; закрепление умений и навыков по составлению уравнений химических реакций и уравниванию при помощи метода электронного баланса;
- Воспитательный аспект: формирование эстетического вкуса в результате наблюдения памятников древнерусской архитектуры; расширение кругозора учащихся; а так же бережного отношения к своему здоровью.
- Развивающий аспект: развивать познавательную активность;
Тип урока: изучение нового материала с применением межпредметных связей и информационных образовательных технологий.
Используемые технологии: технология группового обучения, информационно-комуникационная технология
Оборудование: проектор, ноутбук, интерактивная доска, лоток с химическими реактивами, коллекция природных соединений кальция, презентация урока в программе Power Point, СD-диск с демонстрационным опытом, таблицы для учащихся "Основные соединения кальция"
Реактивы: штатив для пробирок, пробирка, не большой кусочек мела, раствор НСl.
Ход урока
(перед уроком учащиеся делятся на три группы по пять человек в каждой, вытягивая цветной жетон)
1. Знакомство с учащимися
Учитель: Мы много говорим о значении той или иной науки в жизни, но иногда затрудняемся ответить на вопрос: где могут пригодиться в жизни знания по данной теме. Сегодня мы попытаемся ответить на эти вопросы в результате знакомства с основными природными соединениями кальция и их значением в нашей жизни.
2. Актуализация знаний
Кальций - один из самых распространенных элементов на Земле. В природе его очень много: из солей кальция образованы горные массивы и глинистые породы, он есть в морской и речной воде, входит в состав растительных и животных организмов.
Кальций постоянно окружает нас, горожан: почти все основные стройматериалы - бетон, стекло, кирпич, цемент, известь - содержат этот элемент в значительных количествах. Даже
пролетая в самолете на многокилометровой высоте, мы не избавляемся от постоянного соседства с элементом №20. Если, допустим, в самолете находится 100 человек, то, значит, этот самолет несет на борту примерно 100 кг кальция, т.к. в организме каждого взрослого человека не меньше килограмма этого элемента. Не исключено, что во время полета количество кальция вблизи нас намного больше: известно,что сплавы кальция с магнием применяются в самолетостроении. Словом,от кальция - никуда, и без кальция тоже.
(слайды2-6)
Вопрос: Встречается ли кальций в природе в свободном виде и почему?
Предполагаемый ответ: Нет, так как кальций является активным химическим элементом, он встречается в природе только виде различных соединений.
3. Изучение нового материала
Учитель: Так какие же соединения кальция наиболее часто встречаются в природе и используются человеком.
Задание: Рассмотреть образцы представленных соединений, заполнить пропуски в таблице (см. приложение)
(идет рассказ учителя, показ слайдов, работа с терминологией, номенклатурой и коллекцией, учащиеся заполняют таблицу)
Учитель: Соли кальция образуют в природе большие скопления в виде карбонатов, сульфатов, фосфатов. Карбонат кальция СаCO3 - одно из самых распространенных на Земле соединений. Минералы на основе СаCO3 покрывают около 40 млн. км2 земной поверхности. Мел, мрамор, известняки, ракушечники - все это СаCO3 с незначительными примесями, а кальцит - чистый минерал СаCO3, не содержащий примеси (слайд 7,8 )
Известняки образуются в течение 230-240 млн.лет. Это осадочная горная порода, состоящая из минерала кальцита - это пористый и сравнительно мягкий в обработке камень. Его можно ломать, распиливать, резать и шлифовать
Люди научились применять известняки довольно давно. С XI века на Руси началось каменное строительство, белокаменные сооружения великих, русских городов - гордость древнерусской архитектуры, они пленяют своей первозданностью и красотой.
1. Владимирский Успенский собор - построенный в 1158-1160 годах, он послужил образцом при строительстве более поздних соборов. Собор сооружен из белого тесаного камня по заказу владимирского князя Андрея Боголюбского. Успенский собор в Нижнем Новгороде. Его украшают щелевидные окна на барабане и шлемовидные купола (слайд 9);
Жемчужина древнерусской архитектуры - церковь Покрова на Нерли во Владимирской области (слайд 10);
Величественные, могучие, торжественные. Недаром русские поэты посвящали им свои произведения. Например, строки из произведения А.С.Пушкина "Евгений Онегин":
Но вот уж близко. Перед ними
Уж белокаменной Москвы,
Как жар, крестами золотыми
Горят старинные главы:
Эти и еще многие другие памятники архитектуры в нашей стране построены с использованием свойств, так называемого белого камня.
Вопрос: Ребята, как вы думаете, что называли тогда "белым камнем"?
Предполагаемый ответ: Известняк.
Учитель: Верно. Русские мастера каменных дел хорошо разбирались в возможностях белого камня. Стены выкладывались из нарезанных каменных блоков, используя известковый раствор в смеси с песком, наружную сторону тщательно шлифовали, а промежутки между стенами заполняли известковым бутом (обломки горной породы). Все это заливали известью. Такой раствор под действием углекислого газа воздуха постепенно твердел и прочно скреплял камень. Давайте составим уравнения химических реакции, лежащих в основе данных процессов
(слайд 11).
(к доске по очереди выходят по одному представителю от каждой группы)
Учитель: Известковый раствор готовили на месте, используя известняк не пригодный в строительстве. Камни обжигали в специальных печах при высокой температуре, в результате они становились намного легче:
Ученик 1 группы на доске:
![]()
Учитель: Обожженные камни обливались холодной водой, и они распадались на мелкие комочки. В результате данной реакции выделяется очень много теплоты и поэтому строители СаО называли "кипелкой"
Ученик 2 группы:
![]()
Учитель: Свежегашеная известь сразу же использовалась для приготовления раствора. Чем больше она лежала, тем больше теряла свои качества и становилась, как тогда говорили, неклейкой. Для того, что бы разобраться, почему это происходило, давайте составим соответствующее уравнение.
Ученик 3 группы:
![]()
Жидкость поглощала из воздуха углекислый газ и становилась белого цвета. Эта реакция используется в лаборатории для определения углекислого газа (демонстрация опыта)
Мрамор, в отличие от известняка, встречается реже. Считается, что мрамор образовался из известняка в давние геологические эпохи. При смещениях земной коры отдельные залежи известняка оказывались погребенными под слоями других пород. Под действием высокого давления и температуры там происходил процесс перекристаллизации, и известняк превращался в более плотную кристаллическую породу - мрамор.
Естественный цвет мрамора - белый, но чаще всего различные примеси окрашивают его в разнообразные цвета. Чистый белый мрамор встречается не часто и идет в основном в мастерские скульпторов. Из менее ценных сортов белого мрамора делают распределительные щиты и панели в электротехнике. В строительстве мрамор (всех цветов и оттенков) используют не только как конструкционный, но и как облицовочный материал.
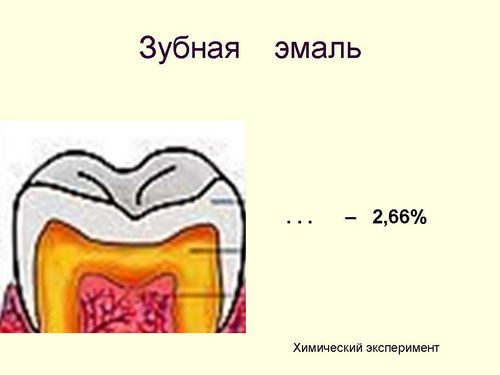
Мел - это не только школьные мелки. Его используют в бумажной и резиновой промышленности - в качестве наполнителя, в строительстве и при ремонте зданий - для побелки. С самого раннего детства Вам твердят о том, что зубы под воздействием вредных условий могут портиться, возникает кариес, зубной камень, различные воспаления. Чтобы избежать этого, необходимо соблюдать меры гигиены: чистка, полоскание. Так вот, раньше зубы чистили зубными порошками, содержащими абразивный материал - неочищенный мел. Но природный мел состоит из раковин моллюсков, поэтому вызывает царапины на эмали (слайд 13) и зубы быстрее портятся. Кислоты, поступающие с пищей или образующиеся в результате ее пережевывания, постепенно разрушают зубную эмаль, в состав которой входит 2,66% (учитель пишет на слайде %) карбоната кальция. Давайте проведем эксперимент.
Опыт: В пробирку добавить 1 мл раствора разбавленной соляной кислоты и добавить небольшой кусочек мела. Что Вы наблюдаете?
Учитель на доске:
![]()
В ионном виде:
![]()
Примерно вот такой химический процесс и приводит к разрушению зубной эмали. В настоящее время для чистки зубов применяют зубные пасты, в состав которых входят современные абразивные, связывающие, пенообразующие вещества, загустители, которые позволяют бережно ухаживать за зубами, не наносят механических повреждений эмали зубов.
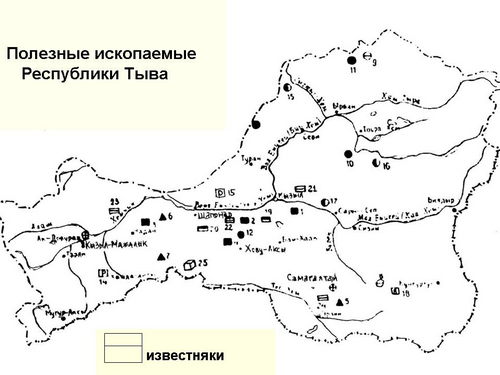
В нашей республике тоже есть залежи известняка. Они находятся на территории Улуг-Хемского, Чеди-Хольского, Эрзинского кожуунов, а залежи мела на территории Овюрского кожууна ( учитель отмечает маркером на слайде основные залежи) (слайды 14)
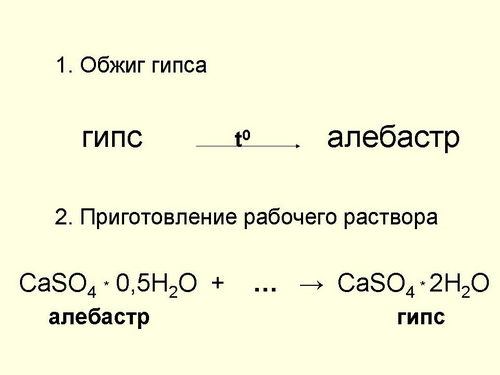
Гипс - как вяжущее вещество используют уже много веков, чуть ли не со времен египетских пирамид. Но природному гипсу (гипсовому камню), несвойственна способность затвердевать на воздухе и при этом скреплять камни. Это свойство гипс приобретает при обжиге. Если природный гипс прокалить при температуре не выше 180°C, то получается кристаллогидрат состава CaSО4 · 0,5H2 O. Это алебастр, или жженый гипс, который и используется в строительстве. Помимо вяжущих свойств у жженого гипса есть еще одно полезное свойство: затвердевая, он немного увеличивается в объеме. Это позволяет получать хорошие слепки из гипса(слайд 15,16).
На интерактивной доске:
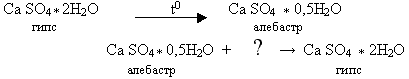
Вопрос: Ребята, посмотрите внимательно на уравнение и скажите, что происходит с раствором алебастры при растворении его в воде?
Предполагаемый ответ: Присоединяет воду.
Учитель: Да, при перемешивании алебастра с водой он присоединяет к себе 1,5 молекулы воды и при этом образуется пластичная масса, которую используют в строительстве и в медицине для наложения гипсовых повязок. А при перемешивании с мелом и песком получают штукатурку, которую до недавнего времени использовали в строительстве в качестве облицовочного материала.
Полевой шпат - СаF2 используется в промышленности для получения различных металлов и в оптике, для получения приборов высокой точности.
(все формулы пишутся маркером на слайдах во время объяснения)
Кальций хлористый шестиводный - СаСl2*6 Н2О - хорошо растворяется в воде. Если полить таким раствором грунтовую или щебеночную дорогу, она останется влажной намного дольше, чем после поливки водой. Это происходит потому, что упругость пара над раствором хлористого кальция очень мала, такой раствор поглощает влагу из воздуха и поэтому долго не высыхает.
Другое применение этой соли связано с низкими температурами замерзания растворов хлористого кальция. Эти растворы используют в холодильных системах.
Хлористый кальций широко применяют и в медицине. В частности, внутривенные инъекции растворов CaCl2 снимают спазмы сердечно-сосудистой системы, улучшают свертываемость крови, помогают в образовании кровяного сгустка - тромба, борется с отеками, воспалениями, аллергией. Он так же является одним из компонентов витамина B15.
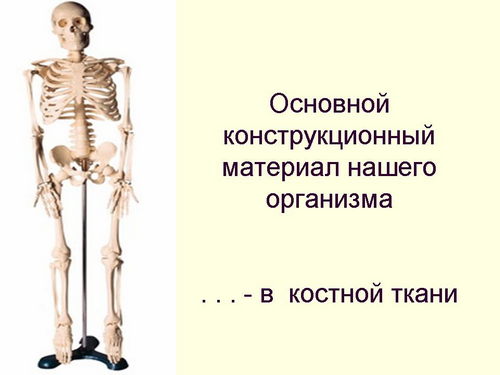
Кальциевая соль ортофосфорной кислоты - основной компонент фосфоритов и апатитов (слайд 17,18) Эти минералы являются сырьем для производства фосфорных удобрений и некоторых других химических продуктов. Фосфат кальция Са3(РO4)2 присутствует в организмах людей и животных. Это главный "конструкционный материал" наших костей.
Соединения кальция так же содержатся и в природных водах. С их содержанием связано такое понятие как жесткость воды, о которой более подробно Вам будут рассказывать на следующих уроках.
Существующие природные соединения кальция не удовлетворяют всех потребностей человека и поэтому люди стали получать искусственным путем еще много различных полезных соединений:
Хлорная известь -Са(ClO)Cl - содержит 99% активного хлора и поэтому используется для отбеливания ткани, бумаги, для дезинфекции воды (слайд 19)
Учитель на доске:
![]()
В преддверии празднования 65-летнего юбилея Победы во II мировой войне хочется вспомнить и тот факт, что соединения кальция использовались в качестве топлива для подводных лодок:
На доске:
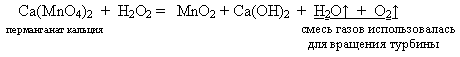
Данный вид топлива так же использовался в дальнейшем и для самолетов.
Задание: Уравнять уравнение методом электронного баланса (к доске вызывается ученик)
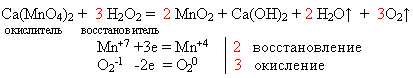
3. Обобщение знаний
Сегодня на уроке мы познакомились с основными соединениями кальция и их применением. В качестве итога нашего урока предлагаю вам выполнить следующее задание.
Задание 1. Распределите данный перечень по предложенным областям применения:
Резина, витамины, парфюмерия, бетонные блоки, облицовочная плитка, оптические приборы, известковый раствор, архитектура, минеральные удобрения, зубная паста, бумага, гипсовые повязки, цемент, лекарства, отбеливание тканей, дезинфекция воды, топливо.
(Группам раздаются ватманы, маркеры, учащиеся заполняют схему в течении 2 мин, затем, представители групп выходят к доске и дополняют центральную схему своими примерами)
Домашнее задание:
Прочитать параграф 79-81. Заполнить 5 колонку в таблице.
Письменно:
- Оценить предложенное уравнение(cм. ОВР), как возможный источник экологического загрязнения окружающей среды.
- Решите задачу: Вычислите, какая масса известняка, содержащего 10% примесей, потребуется для приготовления 3 кг негашеной извести?
- Составьте уравнения согласно схеме: Са -> СаО -> Са(ОН)2 -> CaSO4 -> гипс -> алебастр
На оценку
- На "5" - 1 -3 задания;
- на "4" - два на выбор;
- на "3" - одно на выбор.
Рефлексия.
На вырезанных цветных ладошках учащиеся пишут на одной стороне, что понравилось на уроке, а на другой - что не понравилось.