Цели урока:
Образовательные:
- Ввести понятие внутренней энергии,
- Раскрыть научное мировоззренческое значение внутренней энергии тела как суммы кинетической энергии движение молекул и потенциальной энергии их взаимодействия.
- Познакомить учащихся с двумя способами изменения внутренней энергии,
- Учиться решать качественные задачи,
Развивающие:
Развивать:
- Умение применять знания теории на практике
- Наблюдательность и самостоятельность
- Мышление учеников посредством логических учебных действий
Воспитательные:
Продолжить формирование представления о единстве и взаимосвязи явлений природы
План урока:
Знать:
- Молекулярно-кинетическая трактовка понятия внутренней энергии тела.
- Вывод формулы внутренней энергии идеального газа
- Способы изменения внутренней и повышение работы
Уметь:
Формулировать гипотезы и делать выводы, решать качественные задачи
Тип урока:
Изучение нового материала.
Форма урока: комбинированный.
Комплексно-методическое обеспечение, мультимедийный проектор, компьютер, экран.
Методы обучения.
- Словесные.
- Наглядные.
- Практические.
Ход урока
Тема: Внутренняя энергия
1. Организационный момент.
2. Изучение нового материала.
Внутренняя энергия. Внутренняя энергия идеального газа.
Из 8-го класса нам известно, что внутренняя энергия - это энергия движения и взаимодействия частиц (молекул), из которых состоит тело.
При этом мы исключаем из рассмотрения механическую энергию тела, как единого целого (считаем, что тело неподвижно в данной системе отсчета и потенциальная энергия его взаимодействия с другими телами равно 0).
Таким образом, нас интересует только энергия хаотического движения молекул и их взаимодействие друг с другом. Внутренняя энергия - это функция состояния тела, т.е. зависит от температуры и других параметров системы.
Внутренняя энергия обозначается - U.
![]()
Внутренняя энергия идеального газа.
Попытаемся вычислить внутреннюю энергию идеального газа. Идеальный газ - это модель очень разряженного газа в котором можно пренебречь взаимодействием молекул, т.е. внутренняя энергия идеального газа состоит только из кинетической энергии движения молекул, которую легко вычислить через среднюю кинетическую энергию движения:
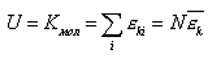
Средняя кинетическая энергия движения молекул нам уже известна:
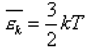
Теперь мы можем легко сосчитать внутреннюю энергию:
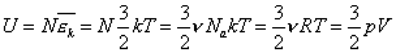
Эта формула верна только для одноатомного газа.
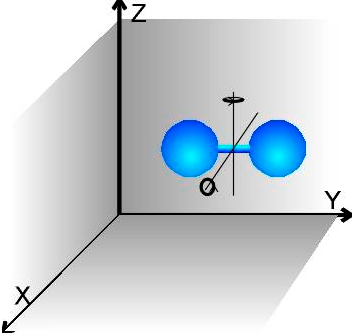
Если молекулы газа двухатомные (молекула похожа на гантельку), то формула будет другой:
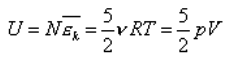
Почему энергия стала больше - объясняется легко, если, дело в том, что двухатомная молекула может не только двигаться поступательно, но еще и вращаться. Вращение, оказывается, дает тоже вклад в среднюю кинетическую энергию молекулы.
Как учесть вклад в энергию вращения молекул?
Оказывается, можно доказать теорему о равнораспределении энергии по степеням свободы, в которой утверждается, что на каждую степень свободы движения молекул в среднем приходится 1/2кТ энергии.
Что такое степени свободы?
Вид молеуклы |
Какие движения молекулы возможны |
количество степеней свободы |
одноатомный газ
|
Любое движение можно представить, как сумму движений по трем независимым направлениям: x, y, z, вращение мы не учитываем, так молекулу считаем мат. точкой. | 3 степени свободы |
двухатомный газ
|
У молекулы кроме поступательного движения возможны еще вращения вокруг двух осей (любое вращение можно представить, как сумму вращений вокруг двух осей). Вращение относительно оси, проходящей вдоль молекулы, мы не учитываем, так молекулы считаем мат. точками. Мы считаем, что колебания атомов в молекуле не возникают. | 3+2=5степеней свободы |
В молекуле газа три и больше атомов. |
Есть поступательное движение (3 степени свободы) и возможны вращения вокруг трех осей (еще 3 степени свободы). Колебаний атомов нет. | 3+3=6 степеней свободы. |
3. Решение качественных задач
Решение качественных задач (контроль)
1. Молекулярный кислород находится под давлением 805 Па в сосуде объемом 0,8 м3.
При изохорном охлаждении внутренняя энергия газа уменьшится на 100 кДж.
Чему равно конечное давление кислорода.
ДАНО:
О2
Р1 =105 Па
V = const
V = 0,8 м3
![]() U = -100Дж
U = -100Дж
Р2 - ?
Решение
Давление упало, Р2 = Р1 - ![]() Р
Р
i = 5 – число степеней свободы
U1 = 5/2 (p1V) ; U2 = 5/2 (p2V)
U = U1 – U2 =5/2(V?p) =>
![]() p = 2
p = 2![]() U/5V
U/5V
p2= p1- (2![]() U/5V)
U/5V)
p2 = 105 Па – (2 105Дж/5 0,8 м3) = 105 Па – 0,5 105 Па = 0,5 105 Па = 5 104
Па
Ответ: p2 =5 104 Па.
2. Определите, какое давление воздуха установится в двух комнатах, имеющих объем V 1 и V2 если между ними открывается дверь.
Первоначальное давление в комнатах p1 и p2, а температура одинакова.
ДАНО:
Р1 , V 1.
P2, V2.
Р-?
Решение
p1V1= m1//![]() RT => m1 =( p 1V 1 M )/
RT до открытия двери;
RT => m1 =( p 1V 1 M )/
RT до открытия двери;
p2V2= m2//![]() RT => m2 =(p 2V 2 M) / RT
до открытия двери.
RT => m2 =(p 2V 2 M) / RT
до открытия двери.
Открыли дверь:
p (V1+V2) = (m1+m2 /M) RT = ((p 1V 1M + p 2V 2 M) / RTM) RT=
(p 1V 1+ p 2V 2 ) / 1 = p 1V 1+ p 2V 2
P =(p 1V 1+ p 2V 2 )/V1+V2
Ответ: (p 1V 1+ p 2V 2 )/V1+V2
3. Воздух массой 87 кг нагревается от 10° С до 30° С Определите изменение внутренней энергии воздуха. Молекулярную массу воздуха следует принять равной 2,9 10-2 кг/моль, а воздух считается двухатомным (идеальным) газом.
ДАНО:
Воздух
m = 87 кг
t = 10° С
t = 30° С
![]() U = -?
U = -?
Решение
![]() U = (5/2 m/M) R?T i=5число
степеней свободы.
U = (5/2 m/M) R?T i=5число
степеней свободы.
M = 2,9 10-2 кг/моль.
![]() T = t2 – t1 = 20K
T = t2 – t1 = 20K
![]() U=
U= 
![]() U= 1,25 х106Дж.
U= 1,25 х106Дж.
Ответ: ![]() U= 1,25 х106Дж.
U= 1,25 х106Дж.