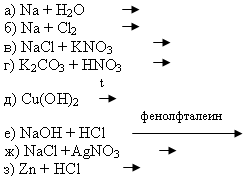Российское фундаментальное образование строилось на знаньевой парадигме. Основное внимание уделялось усвоению знаний. Считалось, что сам процесс усвоения знаний обладает развивающим потенциалом, что именно в процессе обучения должны формироваться необходимые умения и навыки. Отличием школьных стандартов нового поколения является их ориентация на достижение не только предметных образовательных результатов, но на формирование личности учащегося, овладение им универсальными, метапредметными способами учебной деятельности, обеспечивающими успешность в познавательной деятельности на всех этапах его образования.
Деятельностный подход – это основа концепции развивающего обучения. Деятельностная технология обучения позволяет превратить ученика из пассивного объекта педагогического воздействия в активного субъекта учебно-познавательной деятельности. Деятельностный подход определяет цель школьного обучения как формирование умения учиться как компетенции, обеспечивающей овладение новыми компетенциями.
Задача учителя не в том, чтобы наглядно и доступно все объяснить, рассказать и показать детям, а в создании условий для формирования у обучаемых опыта самостоятельного решения познавательных, коммуникативных, организационных, нравственных и других проблем, составляющих содержание образования.
Процесс обучения – это обучение деятельности. Обучать деятельности – значит делать учение мотивированным, учить ребенка самостоятельно ставить перед собой цель и находить пути и средства ее достижения, а также формировать у учащегося умения контроля и самоконтроля, оценки и самооценки.
Предлагаемый урок химии в 9-м классе разработан в рамках технологии деятельностного метода обучения.
“Электролитическая диссоциация” (9-й класс).
Урок: “Реакции ионного обмена”.
Цели урока:
- углубление понятий “реакции обмена”, “электролитическая диссоциация”;
- овладение умением составлять ионные уравнения;
- активизация познавательной деятельности учащихся.
| I этап: Самоопределение к деятельности. Цель: обозначение области содержания урока. Результат: мотивация. |
|
| II этап: Актуализация. Цель: повторение необходимых ЗУН. Результат: фиксация затруднений. |
|
| III этап: Постановка учебной задачи. Цель: постановка учебной задачи. Результат: тема и цель урока. |
Учащиеся в беседе с учителем: – озвучивают проблему: почему не наблюдаются признаки реакции в одном из опытов; – формулируют цель урока: выяснить, почему одни реакции обмена протекают до конца, а другие нет; – записывают тему урока: “Условия протекания реакций обмена”. |
| IV этап: Построение проекта ликвидации причин
затруднений. Цель: построение учащимися нового способа действий. Результат: новый алгоритм действий |
|
| V этап: Первичное закрепление. Цель: вербальное фиксирование нового знания. Результат: структурное оформление нового алгоритма действий. |
|
| VI этап: Самостоятельная работа с самопроверкой. Цель: самоконтроль усвоения знаний. Результат: индивидуальная рефлексия. |
Учащимся предлагается самостоятельно составить
молекулярные и ионные уравнения взаимодействия:
Проверить себя они могут по таблице 4 на стр. 17 учебника Г.Е. Рудзитиса, Ф.Г. Фельдмана “Химия – 9”. |
| VII этап: Введение знаний в систему. Цель: включение нового знания в систему, установка локальных связей нового знания с имеющимися. Результат: проект дальнейшей работы с новым знанием. |
Учащиеся с помощью учителя обобщают полученные за урок
новые сведения.
Учитель сообщает, что эти знания понадобятся им на следующем уроке, где они рассмотрят свойства оснований и кислот в свете теории диссоциации. |
| VIII этап: Рефлексия. Цель: самооценка. Результат: анализ собственной познавательной деятельности. |
Учащимся предлагается оценить свою работу на уроке по
направлениям: – “я” – как я себя чувствовал в процессе урока, доволен ли я своей работой; – “мы” – насколько комфортно и эффективно мне было работать в малой группе; – “дело” – достиг ли я цели обучения, в чем испытал затруднения, как преодолеть проблемы. Учитель благодарит учащихся за их работу на уроке, сообщает оценки за урок и домашнее задание. |