Количество учебного времени 1 час.
Тип урока: формирование новых знаний.
Урок проходит в форме обсуждения и исследования с использованием проблемного подхода на основе личностно-ориентированного обучения. Форма организации познавательной деятельности обучающихся парная и индивидуальная.
Методы работы. Диалогические, экспериментально-исследовательские.
Цели урока:
- вызвать устойчивый интерес к изучаемой теме, мотивировать учебную деятельность обучающихся;
- изучить строение молекулы аммиака; историю происхождения химического названия и физические свойства, спрогнозировать химические свойства аммиака на основании строения его молекулы, спрогнозировать практическое применение этого вещества на основании его физических и химических свойств;
- изучить способы получения аммиака и его свойства через проведение лабораторных опытов;
- сформировать умения правильного обращения с аммиаком, аммиачной водой и оказания первой помощи при отравлении парами аммиака;
- продолжить формирование коммуникативных умений обучающихся;
- активизировать познавательную деятельность обучающихся путём вовлечения их в исследовательскую деятельность и творческую работу.
Развивать
- любознательность и интерес к химической науке, наблюдательность, логическое мышление, умение анализировать свою деятельность, делать выводы из наблюдаемых явлений, познавательные способности;
- навыки проведения химического эксперимента, исследовательские навыки,
- умения прогнозирования;
- развить умения работать с дополнительными источниками, ПК для получения и обработки информации, работать в паре.
Воспитывающие цели:
Формирование навыков поведения обучающихся в коллективном и индивидуальном учебном труде, воспитание экологической культуры; бережного отношения к здоровью как ценности для человека, привычки соблюдать правила безопасности при проведении исследовательских работ, умение слушать сверстников.
Задачи урока.
1) Рассмотреть строение молекулы аммиака и на его основе спрогнозировать свойства вещества;
2) изучить физические свойства аммиака и особенности химических свойств;
3) сформировать представление о возможных направлениях протекания реакции в зависимости от условий на примере реакции горения аммиака;
3) закрепить умения и навыки безопасного проведения химического эксперимента с водным раствором аммиака и правильного обращения с данным веществом в быту;
4) выявить способности применения опорных знаний об электронном строении атомов химических элементов, видах химической связи, свойствах основных классов неорганических соединений;
5) показать значение аммиака в жизни человека, действие его на организм;
6) активизировать познавательную деятельность учащихся с помощью работы с дополнительной литературой и исследовательской деятельности;
7) развить коммуникативные качества обучающихся при выступлении со своими сообщениями по изучаемой теме.
Обучающиеся должны знать и уметь:
- Правила обращения с аммиачной водой;
- правила оказания первой помощи при отравлении аммиаком;
- владеть информацией об экологических проблемах, связанных с авариями при производстве и транспортировке аммиака, и на производствах, использующих аммиак;
- уметь экспериментально распознавать аммиак;
- писать химические формулы и уравнения реакций с участием аммиака и аммиачной воды;
Оборудование: Таблица растворимости веществ, периодическая система химических элементов Д.И.Менделеева, ПК, проектор, экран, телевизор с DVD, использование мультимедиа презентаций Power Point учителя и обучающихся заранее подготовленных к уроку, набор реактивов: раствор аммиака, 25% раствор соляной кислоты, индикаторы фенолфталеин и универсальный индикатор, раствор сульфата меди (II ), раствор гидроксида натрия, раствор серной кислоты, лабораторная посуда.
Подготовка у уроку: обучающимся дано опережающее задание к уроку подготовить сообщения по вопросам. Время на выступление ограничено не более 2 минут.
ХОД УРОКА
1. Организационный момент урока. Цели и задачи урока.
2
. Психологический настрой. Слово учителя.Начиная изучение новой темы, обратимся к истории.
История произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Как вы думаете, что это был за газ? Почему были от его действия такие последствия? Идёт обсуждение. Сегодня на уроке мы докажем, что газ аммиак не только опасный, но и необходимый.
Изучение темы будет проходить по плану: (Приложение. Презентация. Слайд №2)
- Из истории химических имён.
- Строение молекулы аммиака.
- Физические свойства аммиака. Действие на организм. Правила обращения с аммиаком.
- Химические свойства аммиака.
- Способы получения аммиака в лаборатории и в промышленности.
- Применение аммиака в областях народного хозяйства.
- Экологические проблемы, связанные с утечкой аммиака.
3. Заслушаем сообщения, приготовленные вами к уроку.
3.1. Ученик 1. Из истории химических имён. (Приложение. Презентация слайд №3)
3.2. Учитель. Рассмотрим строение молекулы этого соединения.
Аммиак среди соединений азота является летучим водородным соединением. В свободном состоянии он нигде не встречается. Образует соли, в которых выступает в роли щелочного металла. У всех в домашних аптечках обязательно есть его водный раствор – нашатырный спирт. Его химическая формула NH3 В молекуле содержится один атом азота и три атом водорода. Рассмотрим строение атома азота. На последней оболочке у него пять валентных электронов. Схема строения атома азота выглядит так:
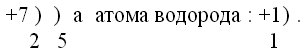
Электронная формула атома водорода 1S1.
Электронная формула атома азота имеет вид: 1S22S22P3.
У атома водорода один не спаренный электрон. Так как каждый атом стремится завершить свою последнюю оболочку для этого атому азоту необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Связи будут полярные потому, что соединяются разные атомы неметаллов, и так как атом азота более электроотрицателен, он будет сильнее к себе притягивать общие электронные пары. Будет происходить смещение электронов в сторону азота. Образование в молекуле аммиака трёх ковалентных полярных связей N - H можно посмотреть на схеме. У азота валентность – III, степень окисления равна –3. В пространстве молекула аммиака будет иметь форму пирамиды.
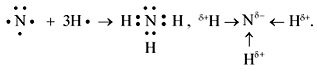
На атоме азота появится отрицательный заряд, а на атомах водорода положительный. Поэтому молекулы аммиака будут притягиваться друг к другу, и между ними будет устанавливаться ещё и водородная связь. Она обозначается тремя точками. (Приложение слайд №9). Присутствие водородной связи в молекуле аммиака объясняет его растворение в воде, и лёгкое сжижение этого газа. (Приложение. Презентация слайд №4-10)
Учитель: Давайте спрогнозируем свойства аммиака на основании строения его молекулы. В какие химические реакции может вступать аммиак благодаря наличию не поделённой электронной пары на атоме азота и трём КПС? В ходе обсуждения обучающиеся приходят к выводу.
Наличие не поделённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в молекуле аммиака будет способствовать тому, что он будет вступать в реакции присоединения протона водорода Н+, то есть реагировать с водой и с растворами кислот, веществами, имеющие протоны водорода.
Исходя из низшей степени окисления атома азота (-3) аммиак будет проявлять только восстановительные свойства в окислительно-восстановительных реакциях.
3.3. Физические свойства аммиака. Определение запаха нашатырного спирта.
(Приложение №2). Ученик 2. Демонстрирует и рассказывает заранее подготовленный ученик.
(Приложение презентация слайд 12,13).
Действие аммиака на организм. Ученик №3
3.4. Учитель: Рассмотрим химические свойства аммиака по плану:
*Взаимодействие с водой. Действие водного раствора аммиака на индикаторы.
*Взаимодействие с кислотами
*Окисление:
- без катализатора;
- с катализатором;
*Взаимодействие с нерастворимым основанием с образованием комплексной соли.
(Приложение. Презентация на слайде №14)
Ученик 3. Нашатырный спирт. Это спирт?
Нашатырный спирт назван спиртом неправильно. Его так называют в быту. Он не относится к классу спиртов, так как спирты – это органические вещества, а нашатырный спирт относится к неорганическим соединениям. Химики называют это соединение гидроксид аммония – это водный раствор газа аммиака NH3. Спирты не изменяют окраску индикаторов и не обладают щелочными свойствами.
Исследуем, как действует нашатырный спирт, то есть водный раствор аммиака на индикатор фенолфталеин и на универсальный индикатор.
Опыт №1. Делают все обучающиеся в парах. (Инструкция. Приложение №4)
О чём свидетельствует окраска индикатора? Ответ обучающихся.
Это говорит о том, что раствор нашатырного спирта обладает щелочной реакцией. На основании изученных свойств спрогнозируем применение аммиачной воды.
Применение нашатырного спирта. Ученик 4.
Нагревание раствора нашатырного спирта. Ученик 5. Демонстрация опыта(ученик заранее подготовлен).
А как будет вести себя раствор аммиака при нагревании?
При нагревании нашатырного спирта газ аммиак очень быстро улетучится и раствор обесцветится а влажная бумага фенолфталеина, поднесённая к отверстию пробирки станет малиновой.
Налить в пробирку раствор аммиака, добавить каплю фенолфталеина и нагревать на спиртовке, до появления обесцвечивания.
NH4OH <–> NH3 ![]() + H2O
+ H2O
Разобрать, используя слайд №17 Презентации донорно-акцепторный механизм образования иона аммония.
Вывод: раствор аммиака обладает основными свойствами, которые будут проявляться в том, что в химических реакциях, аммиак будет присоединять протон водорода, а значит будет вступать в реакцию с водой и кислотами.
Посмотрим процесс растворения аммиака в воде (диск DVD Электронные уроки. “Соединения азота”. Опыт “Фонтан”).
(Приложение. Презентация. Слайд № 15-18)
Реакция аммиака с кислотами. “ Дым без огня” Химические свойства аммиака.
Ученик 6. (Ученик заранее подготовлен).
Аммиак реагирует с кислотами. Например, рассмотрим реакцию взаимодействия аммиака с соляной кислотой. При этом образуются соль, которая называется хлорид аммония, а ещё её называют нашатырь. Её формула NH4Cl. Этот опыт называется дым без огня. Как известно дыма без огня не бывает, но только не в химии. Если смочить две стеклянные палочки, одну раствором аммиака, а другую концентрированной соляной кислотой НCl, то появится белый дым, образованный солью хлоридом аммония, или нашатырём.
Нашатырь представляет из себя твёрдое белое кристаллическое вещество, которое применяется при паянии для очистки поверхности металлов от оксидной плёнки и хорошо пристаёт припой.
Запишем уравнение этой реакции: (Приложение. Презентация. Слайд19)
NH3 + HCl –> NH4Cl.
Взаимодействие аммиака с кислотами. Ученик 7. (Приложение. Презентация. Слайд19)
Аммиак легко реагирует не только с соляной кислотой (ученик подготовлен заранее).
Давайте проверим, а будет ли реагировать аммиак с разбавленной серной кислотой. Проделаем вместе такой опыт. Налить в пробирку 1 мл нашатырного спирта, который является водным раствором аммиака и добавим фенолфталеин. Произойдет окрашивание раствора в малиновый цвет, который говорит о том, что аммиак обладает щелочными свойствами, а теперь прильём раствор серной кислоты, формула которой H2SO4.
Раствор обесцвечивается. Это говорит о том, что произошла химическая реакция, образовалась соль аммиака, которая называется сульфат аммония. Запишем уравнение реакции:
2 NH3 + H2SO4. –> (NH4)2 SO4 (Слайд19)
Итак можно сделать вывод, что раствор аммиака, называемый аммиачной водой, проявляет свойства неорганических оснований, реагируя с кислотами с образованием солей, образуя ион аммония NH4+. Этот ион ведет себя подобно иону металлов и стоит в таблице растворимости вместе с ионами металлов.
Вывод: Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной электронной пары, которая “перетягивает” протон водорода из молекул воды и кислоты.
Рассмотрим окислительно-восстановительные реакции аммиака.
Реакции окисления аммиака могут протекать двумя способами:
1. В отсутствии катализатора.
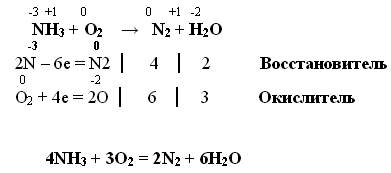
2. В присутствии катализатора
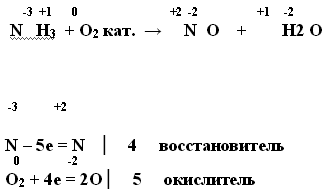
Вывод: Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется.
Как хороший восстановитель взаимодействует с оксидом меди. (Составить дома уравнение).
Учитель. (Приложение №4, презентация слайд №22). Будет ли реагировать водный раствор аммиака с нерастворимым основанием. Выполняем задание №4 с Инструкции. Водный раствор аммиака может образовать окрашенное соединение, которое является комплексной солью.
Запишем уравнение химической реакции. Смотрим слайд №22.
CuSO4 + 2 NaOH –> Cu(OH)2+ Na2SO4
4NH3+ Cu(OH)2 –> [Cu(NH3)4](OH)2
В эту реакцию аммиак вступает за счёт того, что у атома азота есть не поделённая электронная пара. Эта реакция является особенной, так как основание с основанием не должно реагировать.
Способы получения аммиака в лаборатории и в промышленности . (см Презентацию слайд №23,24).
3.5. Просмотр диска DVD запись, выполнения эксперимента получения аммиака в лаборатории обучающимися старших классов на занятиях химического кружка “Химик-теоретик и практик”. Получение аммиака в промышленности обучающиеся изучают самостоятельно дома.
На основании изученных свойств спрогнозируем применение аммиака и его водного раствора.
3.6. Применение аммиака. Ученик 8. (Приложение к уроку№5. Презентация. Слайд №25-27).
Аммиак в медицине. Ученик 9. (Приложение к уроку №6)
3.7. Аварии, связанные с утечкой аммиака. Оказание первой помощи. Ученик 10. (Приложение к уроку №7. Презентация. Слайды №28-30).
4. Закрепление знаний. Что узнали? (На столах карточки с двумя уровнями заданий.)
Обучающиеся отвечают сразу на карточках, выбирая свой уровень.
1 уровень
1) Аммиак ____________ растворяется в воде.
2) Раствор аммиака в воде называют ___________ водой или ___________ спиртом.
3) Под действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на ________________.
4) При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого _______________.
5) Аммиак в реакциях проявляет ______________ свойства.
6) На каких свойствах аммиака основаны методы борьбы с его утечкой?
7) На каких свойствах аммиака основано его применение в медицине, в холодильных установках?
2 уровень
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну. Б. Две. В. Три. Г. Пять.
2) Какое вещество является восстановителем в реакции
NH3 + O2 –> N2 + H2O
А. Аммиак Б. Кислород В. Азот Г. Вода
3) Аммиак не взаимодействует с:
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
4) Установите соответствие:
| Свойства азота | Химические уравнения реакций |
| 1. Реакции, связанные с изменением степени окисления азота. | А. NH3 + H2O <–> NH4OH
Б. 2NH3 <–> N2 + 3H2 В. 4NH3 + 3O2 = 2N2 +6H2O Г. NH3 + HCl = NH4Cl |
| 2. Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму. |
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO3.
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.
Карточки сдаются учителю.
5. Рефлексия.
Составление синквейна. Обучающиеся зачитывают несколько синквейнов про аммиак.
Аммиак какой из каждого пункта плана изучения темы 5 слов или определений.
Например:
- имеет три ковалентные полярные связи в молекуле;
- бесцветный, ядовитый;
- хорошо растворим в воде, изменяет окраску фенолфталеина в малиновый цвет;
- опасный в обращении, раздражает слизистые оболочки;
- поражает растения.
6. Итоги урока.
Домашнее задание § 25. Приготовить презентацию про аммиак.
Осуществить превращение:
N2 –> NH3 –> (NH4)2SO4 –> NH4Cl –> NH3