Цель урока. Изучение свойств соединений серы – сернистого газа, сернистой кислоты и ее солей.
Задачи урока. Повторение, углубление и закрепление знаний учащихся о свойствах кислотных оксидов и кислот. Практическое применение умения составлять уравнения реакций в молекулярном и ионном виде и с точки зрения окислительно-восстановительных процессов.
Учитель. Вам уже известно, что сера может образовывать соединения с кислородом. А какой элемент обладает большей электроотрицательностью: кислород или сера?
Ученики отвечают, что кислород обладает большей электроотрицательностью.
Учитель. Следовательно, в соединениях с кислородом сера проявляет положительную или отрицательную степень окисления?
Ученики отвечают, что сера проявляет в соединениях с кислородом положительную степень окисления.
Учитель. Какие положительные степени окисления может проявлять серы?
Ученики отвечают, что сера проявляет три положительные степени окисления: +2, +4, +6.
Учитель. Составьте и запишите формулы возможных соединений серы с кислородом и назовите эти соединения.
Ученики записывают формулы соответствующих оксидов и рядом записывают их названия.
Учитель. По характеру химических свойств, к каким оксидам можно отнести оксиды серы?
Ученики отвечают, что т.к. сера – это неметалл, то, как все неметаллы образует кислотные оксиды.
Учитель говорит, что только оксиды серы (IV) и (VI) являются кислотными, а оксид серы (II) – это несолеобразующий оксид. Несолеобразующие оксиды — оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют соли.
Остановимся сегодня более подробно на оксиде серы (IV) или сернистом газе.
Учитель может предложить учащимся работу с учебником или показать видеофрагмент на основании, которого необходимо записать физические свойства оксида серы (IV).
Учитель. Как можно получить оксид серы (IV)?
Из предыдущих уроков учащиеся знают, что этот оксид можно получить непосредственным взаимодействием серы с кислородом, при горении сероводорода и обжиге сульфидов металлов.
Учитель предлагает учащимся составить уравнения соответствующих реакций и расставить коэффициенты методом электронного баланса, а также указать окислитель и восстановитель. Данное задание можно выполнить по трем вариантам и затем проверить правильность выполнения у доски. Данное упражнение позволяет повторить и закрепить умение составлять уравнения реакций с точки зрения окисления-восстановления.
Учитель. Мы уже с вами вспомнили, что оксид серы (IV) – это кислотный оксид. Какие химические свойства характерны для кислотных оксидов?
Ученики отвечают, что для соединений проявляющих кислотные свойства характерно взаимодействие с соединениями, проявляющими основные свойства, т.е. с основными оксидами и со щелочами.
Учитель предлагает записать уравнения реакций взаимодействия оксида серы (IV) с оксидом кальция и гидроксидом натрия. После этого спрашивает у учащихся, что является продуктом взаимодействия веществ обладающих кислотными и основными свойствами? Просит назвать продукты реакции. Являются ли эти взаимодействия окислительно-восстановительными реакциями? Почему? Если учащиеся затрудняются ответить, то можно задать наводящий вопрос: “Какие реакции называются окислительно-восстановительными?”
Ученики дают определение окислительно-восстановительных реакций. Для того чтобы определить, являются ли данные реакции окислительно-восстановительными, необходимо определить степени окисления каждого элемента в этих реакциях и проанализировать изменяются они или нет. Учащиеся определяют степень окисления каждого элемента и делают вывод, что данные реакции не являются окислительно-восстановительными.
Учитель: Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также в качестве консерванта (пищевая добавка Е220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Учитель. Ранее (когда обсуждали физические свойства) мы говорили, что сернистый газ растворим в воде. Учитель демонстрирует опыт по сжиганию серы и растворению образовавшегося газа в воде подкрашенной метилоранжем. Учащиеся наблюдают за растворением сернистого газа и изменением окраски раствора с оранжевого на розово-красный. Учитель просит объяснить наблюдаемое явление.
Учащиеся могут объяснить, что белый дым, образующийся при сгорании серы – это сернистый газ или оксид серы (IV). Изменение окраски индикатора в водном растворе говорит о том, что между оксидом серы (IV) и водой произошла химическая реакция, а цвет индикатора указывает на то, что в растворе образовалась кислота.
Учитель предлагает записать уравнение реакции взаимодействия оксида серы (IV) с водой и назвать кислоту, которая образуется в ходе реакции. Далее учитель просит учащихся дать характеристику данной кислоте с точки зрения основности и содержания кислорода.
Учащиеся говорят, что это двухосновная, кислородсодержащая кислота.
Учитель сообщает, что сернистая кислота нестойкая и с течением времени разлагается на воду и сернистый газ. Уравнение соответствующей реакции записывается на доске и в тетради.
Учитель. Так как в ходе опыта изменилась окраска индикатора, то можно судить о том, что в растворе присутствуют ионы водорода, т.е. сернистая кислота в водном растворе диссоциирует на ионы. Запишите уравнение диссоциации сернистой кислоты. Учитель может задать наводящий вопрос: “Как диссоциируют в водном растворе многоосновные кислоты?”
Учащиеся вспоминают, что многоосновные кислоты диссоциируют в водном растворе ступенчато. В нашем случае будут две ступени диссоциации. На доске и в тетради появляется запись:
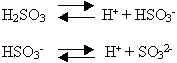
Учитель просит назвать ионы, которые образуются в результате диссоциации.
Учащиеся могут самостоятельно назвать сульфит – ион. Назвать гидросульфит-ион может вызвать затруднение, тогда учитель сообщает, что ион HSO3- называют гидросульфит-ион. Учащиеся записывают около формул ионов их названия.
Учитель напоминает, что если кислота двухосновная, то она образует два кислотных остатка и два вида соли (учащимся это известно из тем “Электролитическая диссоциация” и “Сероводород”): кислую и среднюю.
Учитель. Запишите уравнения реакций взаимодействия сернистой кислоты с 1 моль гидроксида калия и с 2 моль гидроксида калия.
Учащиеся записывают уравнения соответствующих реакций на доске и в тетрадях.
Учитель. Назовите образовавшиеся продукты реакции. Сформулируйте, в каком случае будет образовываться кислая соль, а в каком – средняя?
Учащиеся могут сделать вывод, что при недостатке щелочи образуется кислая соль, а при избытке – средняя.
Учитель. Говорят, что от перестановки мест слагаемых сумма не меняется. Если в одну пробирку сначала налить сернистую кислоту и затем по каплям приливать гидроксид калия, а во вторую пробирку налить гидроксид калия и затем по каплям приливать сернистую кислоту, одинаковые ли соли будут образовываться в каждом случае? (Это задание на развитие логического мышления и умение применить полученные знания в новой ситуации.)
Учащиеся могут сделать вывод, что в первой пробирке в избытке кислоты сначала образуется кислая соль, а затем при добавлении щелочи образуется средняя соль. А во второй пробирке в избытке щелочи сначала образуется средняя соль, а затем по мере добавления кислоты будет образовываться кислая соль.
Учитель просит записать уравнения химических реакций происходящих в первой и второй пробирках (можно по вариантам).
Учитель. Т.к. сернистая кислота неустойчивая, то мы с ней практически не сталкиваемся, но имеем дело с солями сернистой кислоты – сульфитами. Все ли соли сернистой кислоты растворимы?
Учащиеся на основании таблицы растворимости могут сделать вывод, что растворимыми являются сульфиты только щелочных металлов.
Учитель. Как же можно распознать соли сернистой кислоты среди других солей?
Учащиеся затрудняются ответить на этот вопрос.
Учитель говорит, что при добавлению к любому сульфиту сильной кислоты в результате реакции будет выделяться газ и демонстрирует опыт взаимодействия сульфита натрия с соляной кислотой.
Учитель. А почему в результате химической реакции образуется газ? И какой газ образуется? Давайте запишем уравнение реакции.
Учащиеся записывают уравнение реакции взаимодействия сульфита натрия с соляной кислотой.
Учитель просит назвать продукты реакции.
Учащиеся называют хлорид натрия и сернистая кислота.
Учитель. А откуда же берется газ?
Учащиеся могут ответить, что в результате химической реакции образуется нестойкая сернистая кислота, которая распадается на воду и сернистый газ, выделение которого мы и наблюдаем. Если учащиеся затрудняются ответить на поставленный вопрос, то учителю необходимо подвести их к ответу с помощью наводящих вопросов.
Учитель. Какое агрегатное состояние у соли? У кислоты? Есть ли среди образовавшихся веществ неустойчивое вещество, которое может распасться с образованием газообразного вещества. После этого исследования учащиеся в состоянии сделать необходимый вывод. Учитель просит учащихся записать уравнение реакции в полном и кратком ионном виде.
Учитель (или учащийся) демонстрирует реакцию взаимодействия сульфита натрия с хлоридом бария. Учащиеся наблюдают образование осадка белого цвета.
Учитель просит записать уравнение соответствующей реакции в молекулярном и ионном виде, дать объяснение наблюдаемому явлению.
Учащиеся объясняют, что в результате химической реакции образуется нерастворимый сульфит бария.
Учитель (или учащийся) демонстрирует реакцию взаимодействия образовавшегося сульфита бария с соляной кислотой.
Учащиеся наблюдают растворение осадка и выделение газа.
Учитель просит записать уравнение происходящей реакции в молекулярном и ионном виде. После этого учитель просит сделать вывод, как определить соль сернистой кислоты среди остальных солей.
Учащиеся формулируют вывод, что растворимые и нерастворимые сульфиты взаимодействуют с кислотами с образованием сернистого газа, который имеет резкий запах (запах жженых спичек).
Закрепление.
Учитель демонстрирует две пронумерованные пробирки, говорит, что в одной из пробирок находится сульфит натрия, а в другой хлорид натрия. И предлагает учащимся определить, в какой пробирке находится сульфит.
Учащиеся проводят химический эксперимент и делают соответствующий вывод.
Учитель. Почему отсутствуют признаки протекания реакции в другой пробирке?
Учащиеся говорят, что соль хлорид натрия образована соляной кислотой, поэтому реакция между хлоридом натрия и соляной кислотой протекать не будет. Поэтому мы и не видим признаков реакции.
Домашнее задание. (по учебнику Г.Е.Рудзитис, Ф.Г.Фельдман “Химия 9”)
- п.12, стр.34 №4,5
Литература.
Г.Е.Рудзитис, Ф.Г.Фельдман Химия 9 , учебник для 9 кл. общеобразоват. учреждений – 12–е изд., перераб.- М.:Просвещение, 2008
Н.Н. Гара Химия. Уроки химии в 9 классе: пособие для учителя – М. : Просвещение, 2009
Л.М.Кузнецова Материалы курса “Особенности методики преподавания химии в свете деятельностного подхода” лекции 1-8. М: Педагогический университет “Первое сентября”, 2015