Цель: на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы.
Задачи:
Образовательная:
- показать значимость фенола как в народном хозяйстве, так и в быту;
- рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства;
- познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы
- рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль.
Развивающая:
- развивать самостоятельность;
- совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения;
- продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении химического эксперимента.
Воспитательная:
- воспитывать интерес к знаниям;
- продолжить формирование химической картины мира через химическую картину природы (познаваемость, управление химическими процессами);
- расширить представление учащихся о влиянии фенолсодержащих промышленных отходов и строительных материалов на окружающую среду и здоровье человека;
- рассмотреть биологическую роль фенола и его соединений на организм человека (положительную и отрицательную).
Методы и методические приемы: словесный метод, наглядный метод, аналитический, сравнительный, обобщающий метод, самостоятельная работа.
Тип урока: урок повторения и изучения нового материала
Оборудование: С6Н5ОН, NaOH, FeCl3, HNO3 (конц), Na, по три пробирки, вода, спиртовка, пинцет, раствор чая, компьютер, проектор.
|
Ход урока |
Деятельность
|
||||||||||||
|
1. Организационный момент. Об этом веществе вы возможно слышали, когда читали произведения писателей 19 века, например в рассказе М.Зощенко «Перед восходом солнца» есть фраза «Я иду в лазарет и карболкой мою свои руки». Называлось оно раньше карболкой, или карболовой кислотой. Сегодня мы с вами будем говорить об этом веществе. |
Приветствуют | ||||||||||||
|
2. Актуализация знаний.
1. Какие спирты называются ароматическими? 2. Будут ли отличаться химические свойства у соединений, в одном из которых группа -ОН связана непосредственно с бензольным ядром, а в другом через атом углерода? Верно, согласно одного из положений теории Бутлерова, которое гласит, что свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в молекуле, но и от взаимного влияния атомов и групп атомов друг на друга. Причем, наибольшее влияние оказывают атомы непосредственно связанные друг с другом |
Анализ, сравнение, обобщение | ||||||||||||
|
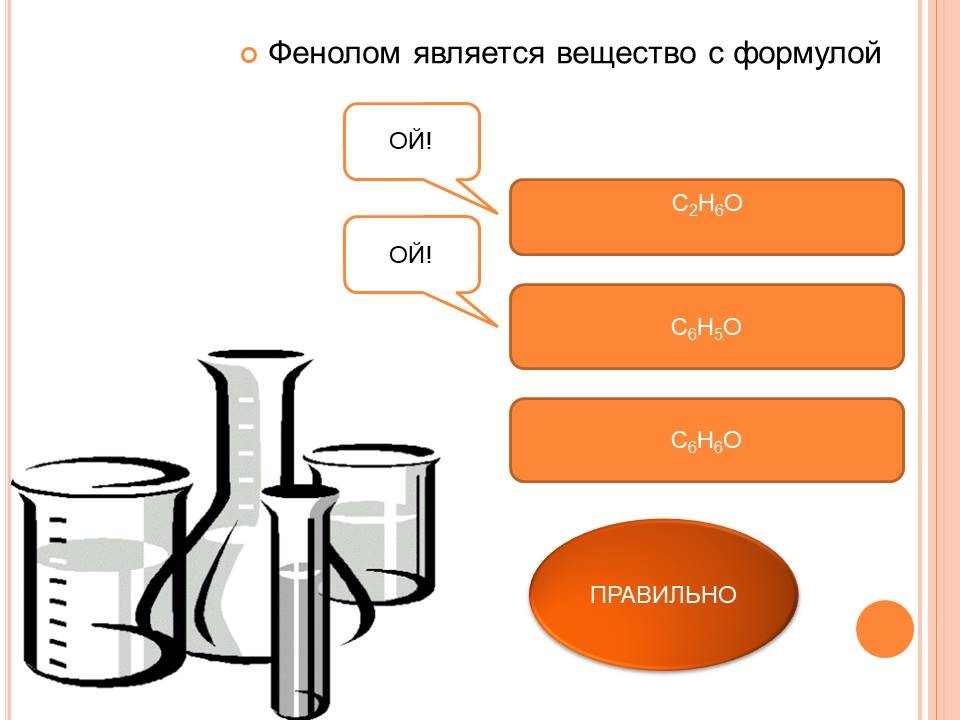
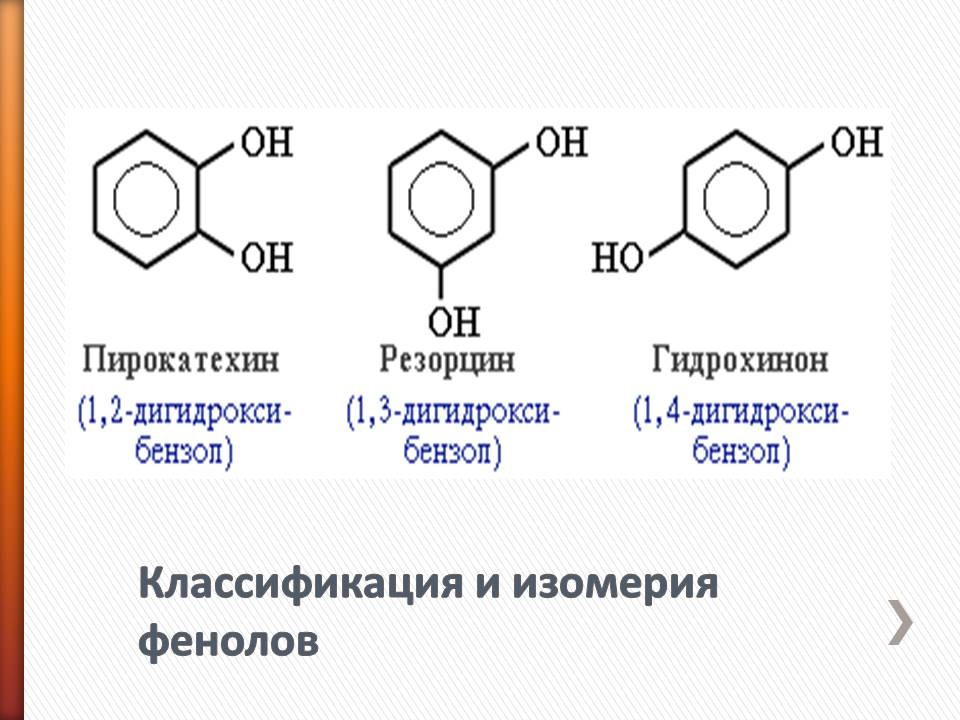
3. Изучение нового материала. (Слайд 2) В «Олесе» Куприна читаем «… Потом я пробовал заняться лечением перебродских жителей. В моем распоряжении были касторовое масло, карболка, борная кислота, йод». И в этом произведении встечается упоминание о карболке. Современное название его - фенол. Определение фенолов: (Слайд 3) Соединения, в которых ароматический радикал фенил С6Н5 - непосредственно связан с гидроксильной группой, отличаются по свойствам от ароматических спиртов, настолько, что их выделяют в отдельный класс органических соединений, называемый фенолами. Классификация и изомерия фенолов: (Слайд 4)
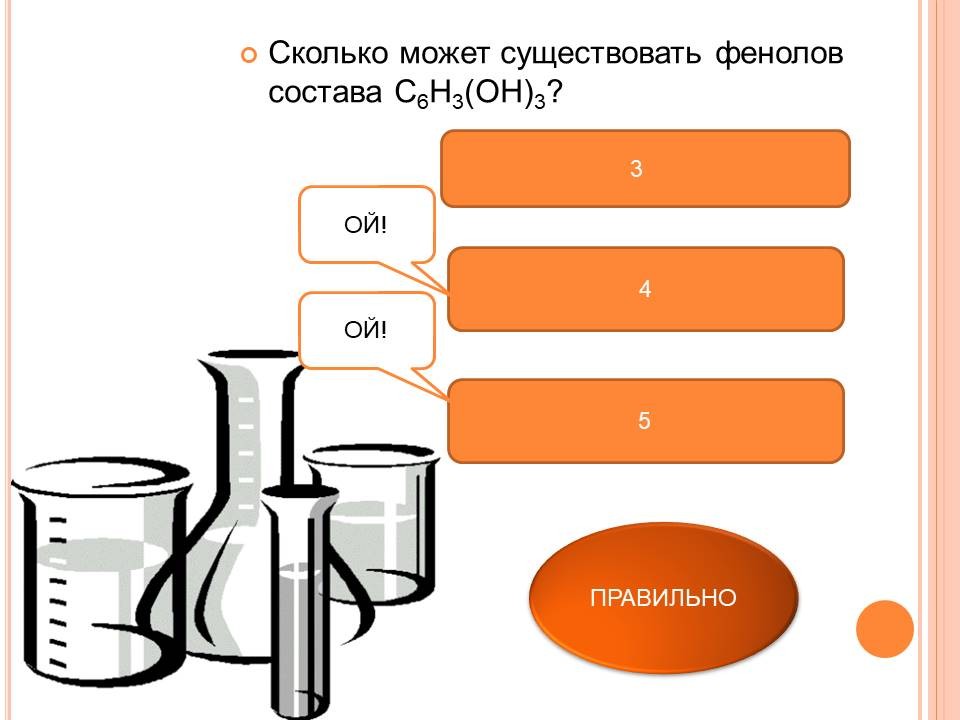
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные.
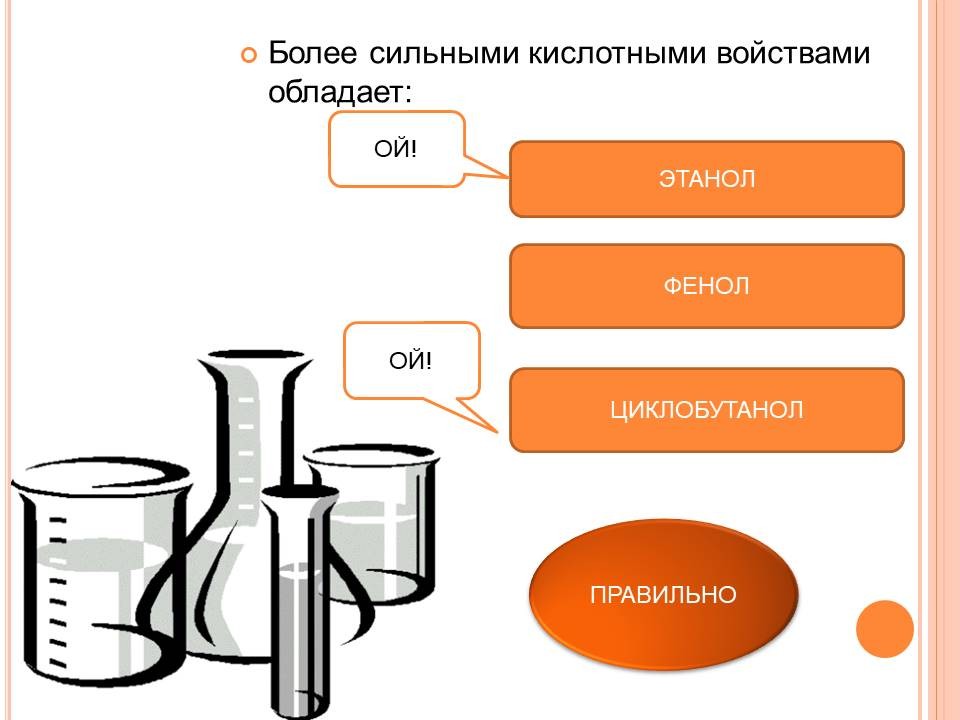
Строение молекулы фенола: (Слайд 5) Неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из-за чего связь О-Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты. В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6 |
Формирование цели и задачи урока | ||||||||||||
|
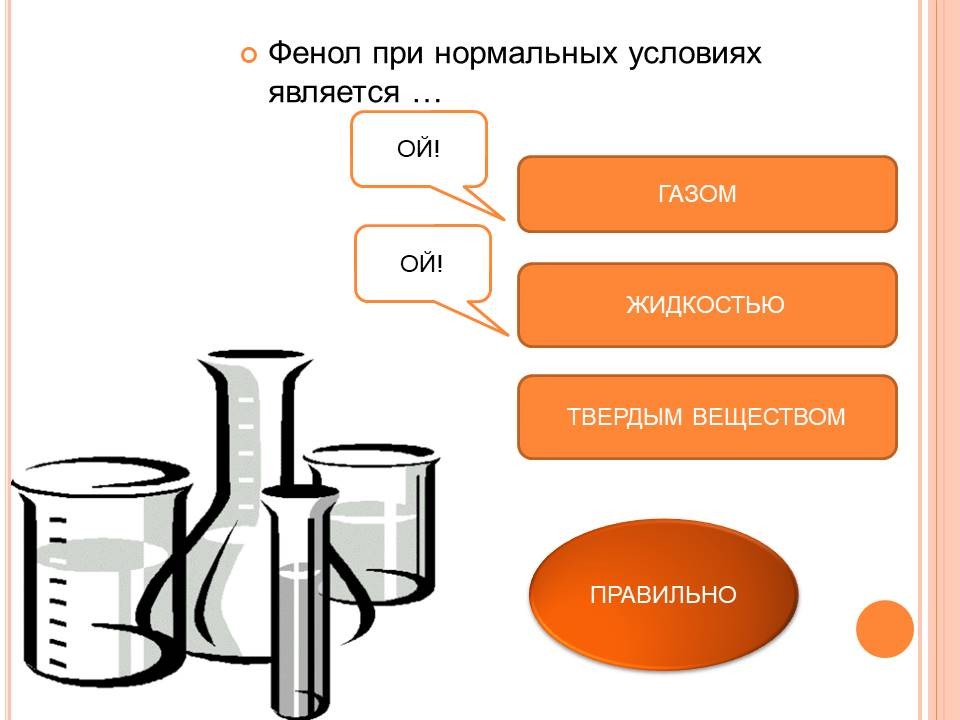
4. Работа по изучению физических и химических свойств фенола. Физические свойства фенола (демонстрационный опыт): 1. Посмотритена вещество, помещенное в пробирку, и опишите его физические свойства. (Слайд 6) 2. Растворяю вещество в холодной воде. Каков результат? (Не растворяется) 3. Слегка нагрею пробирку. Отметьте наблюдения. (Растворился) Делаем вывод о физических свойствах фенола: Следствием полярности связи О-Н и наличия неподеленных пар электронов на атоме кислорода является способность фенола к образованию водородных связей. Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости в воде. Метанол, этанол, пропанол и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. Химические свойства фенола (продолжение демонстрационного эксперимента): (Слайд 7) 4. В первую пробирку налью раствор NaOH и 2-3 капли фенолфталеина, затем 1\3 часть раствора фенола. 5. Во вторую пробирку добавлю 1\3 часть раствора фенола и по каплям раствор FeCl3. 6. В третью пробирку налью осторожно раствор азотной кислоты 2-3 капли метилового-оранжевого и оставшийся раствор фенола. 7. Оформите наблюдения и напишите уравнения реакций.
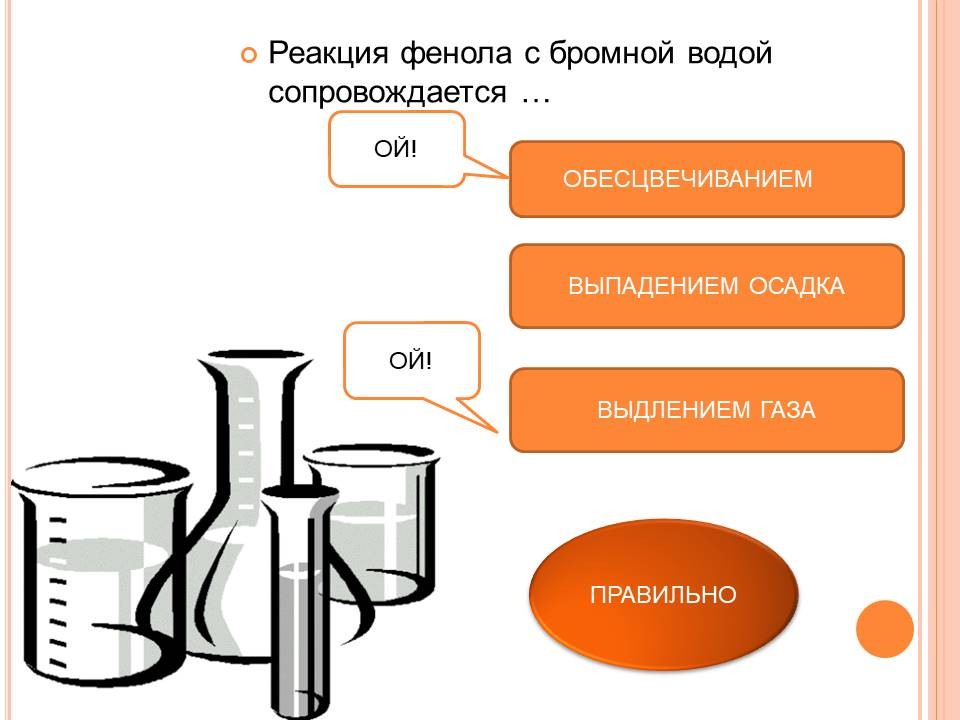
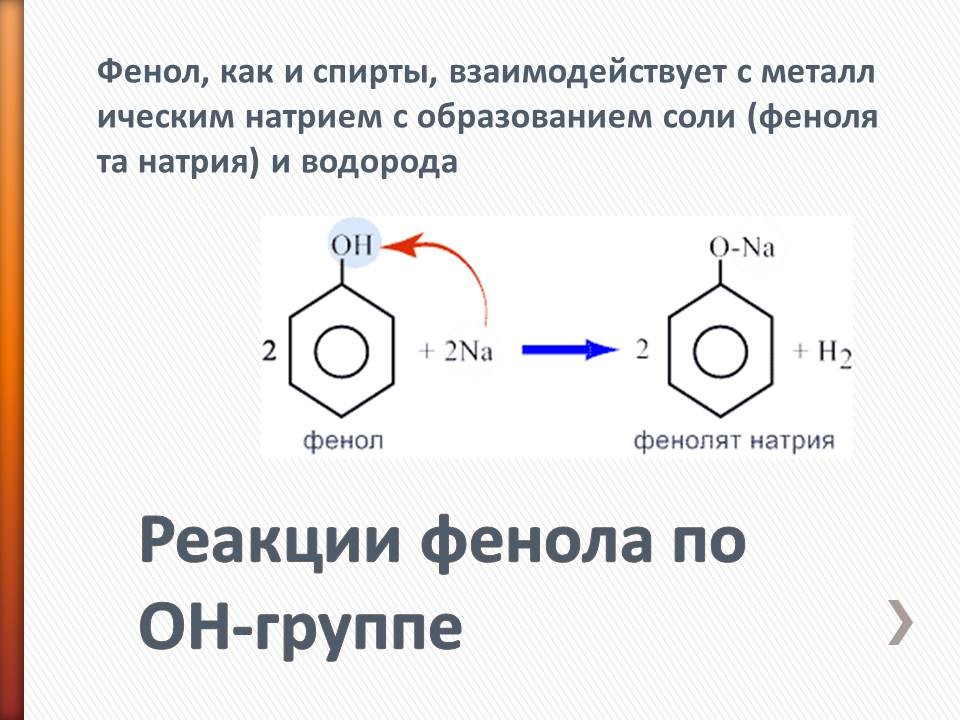
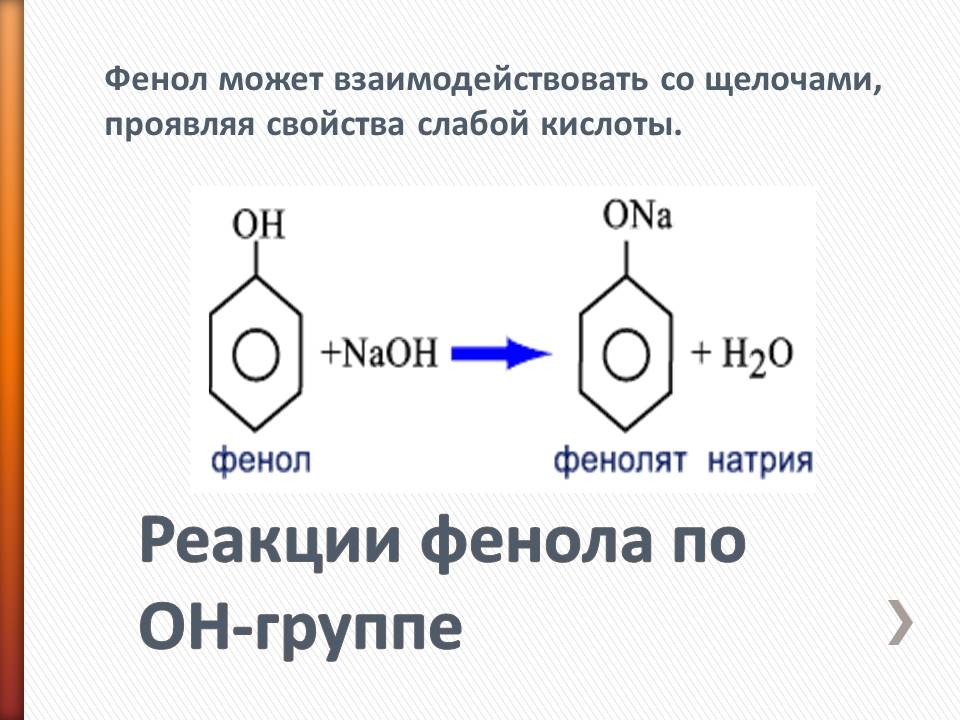
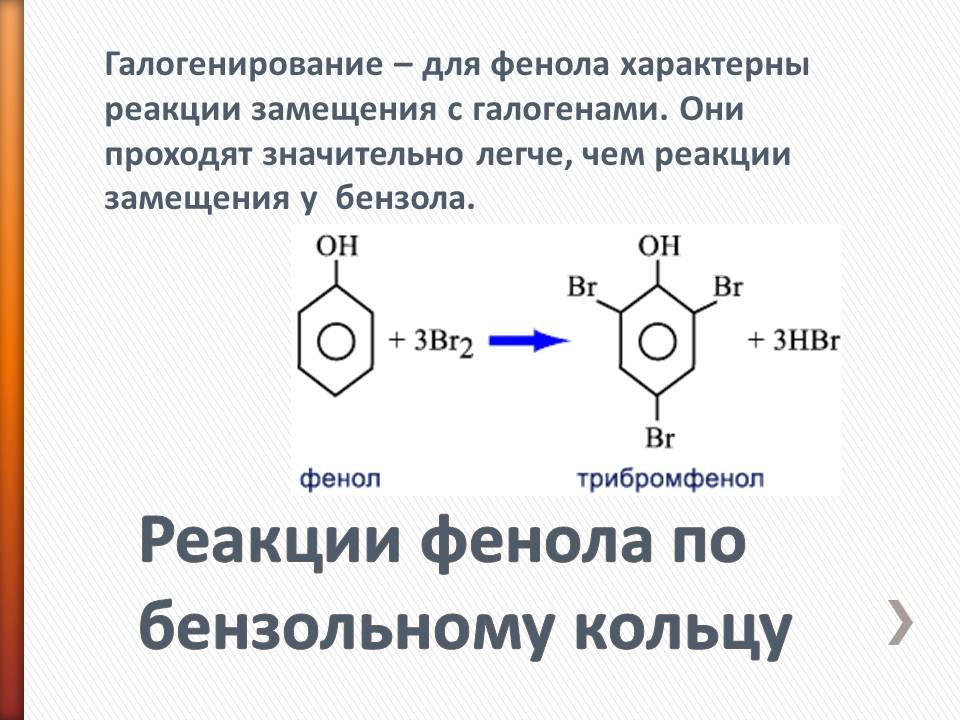
В таблицу записывают следующие уравнения и выводы: а) реакции фенола по ОН-группе: 2C6H5OH + 2Na = 2C6H5ONa + H2 (Слайд 8) C6H5OH + NaOH = C6H5ONa + H2O (Слайд 9) Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол - слабая кислота (карболовая). б) Реакции фенола по бензольному кольцу: С6Н5ОН + 3Br2 = С6Br3OH↓ + 3HBr (Слайд 10) С6Н5ОН + Br2 -> белый осадок. Какой вывод о взаимном влиянии атомов в молекуле фенола можно сделать?
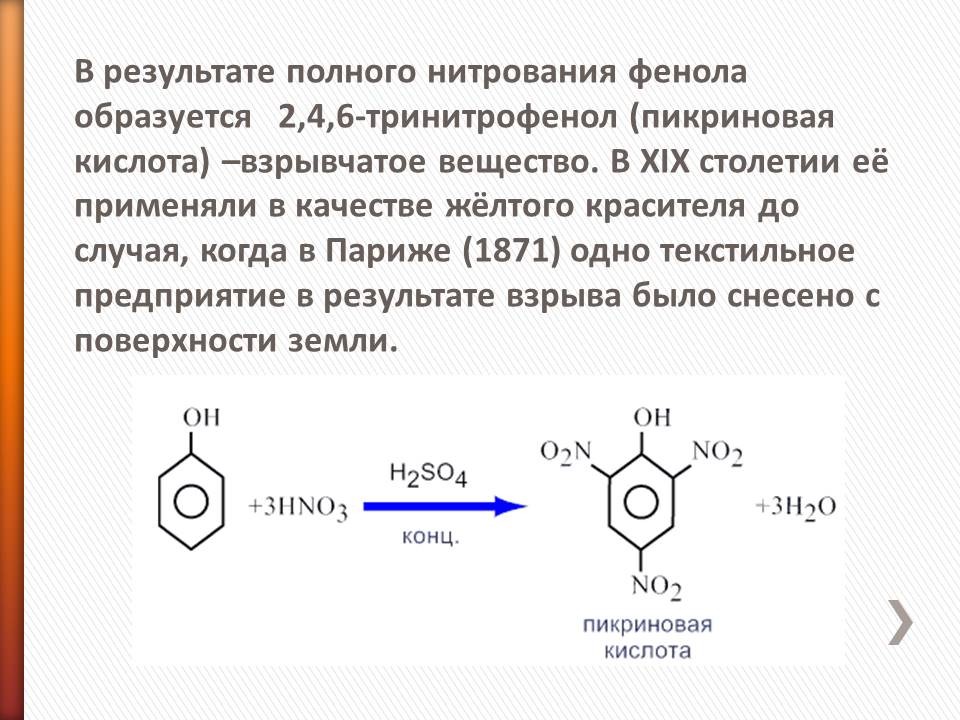
Фенолы, как и толуол замещаются в положения 2,4,6, образуя с НNO3 тринитрофенол (пикриновую кислоту).
в) Качественная реакция на фенолы С6Н5ОН + FeCl3 -> фиолетовое окрашивание.
Фенильная группа C6H5 - и гидроксил -ОН взаимно влияют друг на друга.
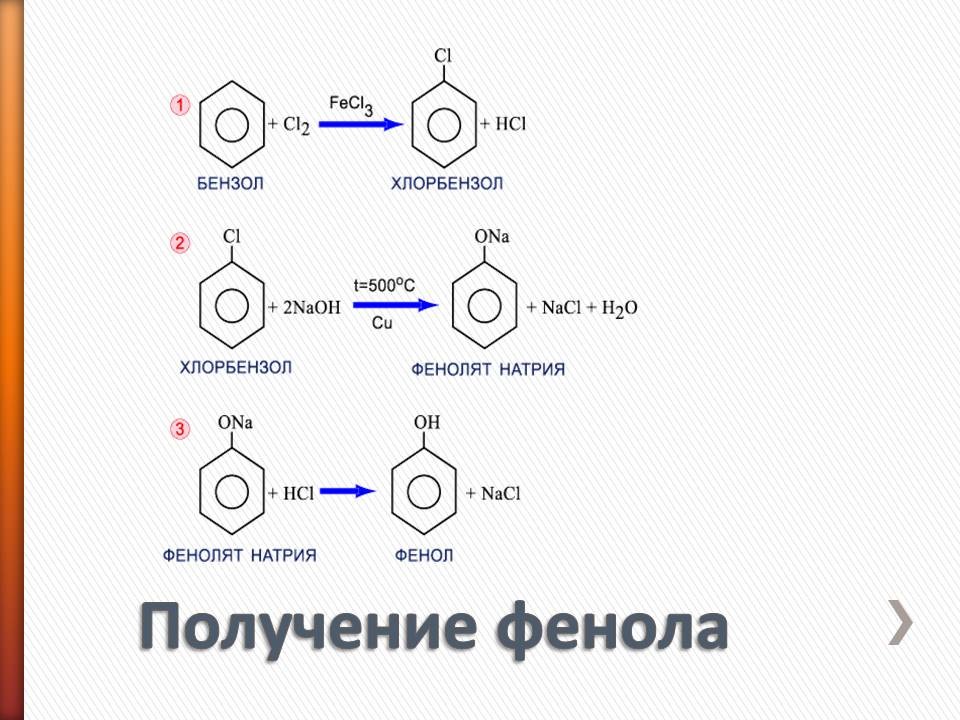
Получение фенола - объяснение по слайдам 12,13. Физиологическое действие фенола и его применение.
Фенол - ядовит!!! При попадании на кожу вызывает ожоги, при этом он всасывается через кожу и вызывает отравление.
Применение: (Слайд 15)
5. Первичное закрепление знаний - тест. (Слайд 16) 6. Домашнее задание. Проработайте записи в тетради по теме урока. 7. Рефлексия. (Слайд 17) Учитель: что нового узнали? Что было трудно?
Оцените себя по 1 из 3 фраз:
|
Выполнение опытов.
Запись в тетрадь |
||||||||||||
Литература
- Журналы «Химия в школе».
- Гара Н.Н. «Поурочные разработки по химии. 10 кл.». Москва, 2011.
- Ресурсы Интернет «Мир химии».
- Рудзитис Г.Е. и Фельдман Ф.Г. «Химия. 10 класс». М.: «Просвещение», 2013.